题目内容
按如图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为 B池为
(2)铁极为 极,电极反应式为 石墨棒C2附近发生的实验现象为 .

(1)判断装置的名称:A池为
(2)铁极为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)A装置中存在自发的氧化还原反应,为原电池;A为B装置提供电源,B为电解池;
(2)原电池中,活泼金属做负极,负极发生氧化反应;C作正极,正极发生还原反应;C2电极与A中负极相连为电解池的阴极,电解氯化钾溶液,氢离子失去电子发生氧化反应.
(2)原电池中,活泼金属做负极,负极发生氧化反应;C作正极,正极发生还原反应;C2电极与A中负极相连为电解池的阴极,电解氯化钾溶液,氢离子失去电子发生氧化反应.
解答:
解:(1)A装置中存在铁与铜离子反应生成亚铁离子和铜自发的氧化还原反应,属于原电池;A为B装置提供电源,B为电解池;
故答案为:原电池;电解池;
(2)A原电池中,铁为活泼金属,做负极发生氧化反应,电极反应式为:Fe-2e-=Fe2+;
石墨棒C2是阴极,该极上是氢离子得电子生成氢气的过程,会有气泡产生,氢离子减小,碱性增强,溶液变为红色,
故答案为:负;Fe-2e-=Fe2+;有气泡产生,溶液变为红色.
故答案为:原电池;电解池;
(2)A原电池中,铁为活泼金属,做负极发生氧化反应,电极反应式为:Fe-2e-=Fe2+;
石墨棒C2是阴极,该极上是氢离子得电子生成氢气的过程,会有气泡产生,氢离子减小,碱性增强,溶液变为红色,
故答案为:负;Fe-2e-=Fe2+;有气泡产生,溶液变为红色.
点评:本题考查了原电池、电解池,明确原电池、电解池工作原理是解题关键,注意电解池、原电池判断方法.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
在25℃时,将两个铂电极插入到一定量的Na2SO4饱和溶液中电解,通电一段时间后,在阴极逸出a mol气体,同时有Wg Na2SO4.10H2O晶体析出.若温度不变,此时剩余Na2SO4溶液的质量分数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.
将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.| A、两烧杯中铝片表面均有气泡产生 |
| B、甲中铝片是正极,乙中铁片是负极 |
| C、两烧杯中溶液的pH均增大 |
| D、产生气泡的速度甲比乙快 |


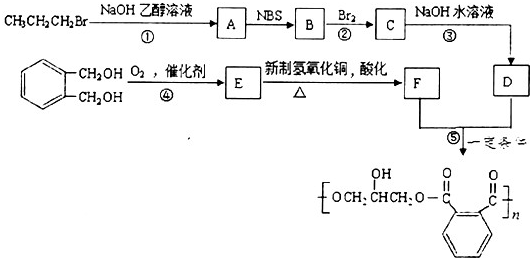
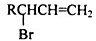
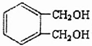 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有