题目内容
锌与100mL1mol/L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠或②溴化铜或③醋酸铜(均为可溶性),并测定生成H2的速率(mL/min),预计三种方案的速率大小是( )
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:反应实质为Zn与氢离子反应,①醋酸钠,与氢离子结合生成醋酸,氢离子浓度减小;②溴化铜与Zn反应生成Cu,构成原电池;③醋酸铜,在构成原电池的同时,氢离子浓度减小,以此来解答.
解答:
解:金属与盐酸反应生成氢气的反应实质为Zn与氢离子反应,
①醋酸钠与氢离子结合生成醋酸,氢离子浓度减小,
②溴化铜与Zn反应生成Cu,构成原电池,
③醋酸铜,在构成原电池的同时,氢离子浓度减小,形成原电池反应速率加快,但氢离子浓度减小,则反应速率较②小,
所以反应速率为②>③>①,
故选C.
①醋酸钠与氢离子结合生成醋酸,氢离子浓度减小,
②溴化铜与Zn反应生成Cu,构成原电池,
③醋酸铜,在构成原电池的同时,氢离子浓度减小,形成原电池反应速率加快,但氢离子浓度减小,则反应速率较②小,
所以反应速率为②>③>①,
故选C.
点评:本题考查影响反应速率的因素,为高频考点,把握浓度、原电池对反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
反应A(g)+3B(g)═2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45mol/(L?s) ②v(B)=0.6mol/(L?s)
③v(C)=0.4mol/(L?s) ④v(D)=0.45mol/(L?s)
下列有关反应速率的比较中正确的是( )
①v(A)=0.45mol/(L?s) ②v(B)=0.6mol/(L?s)
③v(C)=0.4mol/(L?s) ④v(D)=0.45mol/(L?s)
下列有关反应速率的比较中正确的是( )
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
 的正确名称是.
的正确名称是.| A、2,5-二甲基-4-乙基己烷 |
| B、2,5-二甲基-3-乙基己烷 |
| C、3-异丙基-5-甲基己烷 |
| D、2-甲基-4-异丙基己烷 |
下列操作会引起实验误差的是( )
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度的盐酸所用的0.5mol?L-1 NaOH溶液时,用甲基橙为指示剂,在配制标准溶液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往用蒸馏水洗净的滴定管中直接加入待测液,再注入锥形瓶中 |
用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A、溴苯中的溴(苯) |
| B、溴乙烷中的乙醇(水) |
| C、乙烷中的乙烯(酸性KMnO4溶液) |
| D、苯中的甲苯(溴水) |
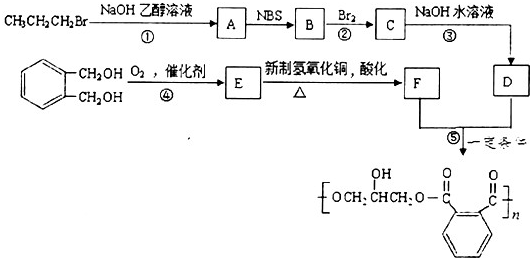
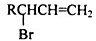
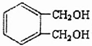 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有
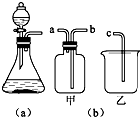 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和