题目内容
13.下列表述方式错误的是( )| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
分析 A.基态铁原子外围电子排布式为3d64s2,根据洪特规则分析;
B.根氯化钠为离子化合物,NaCl为氯化钠的化学式,不存在NaCl分子;
C.N原子核外有7个电子,根据构造原理书写;
D.氯原子最外层电子数是7,形成1个共价键,氧原子最外层电子数为6,形成2个共价键,次氯酸分子中氧原子与氢原子、氯原子之间分别形成1对共用电子对.
解答 解:A.基态铁原子外围电子排布式为3d64s2,根据洪特规则电子总是优先单独占据一个轨道,而且自旋状态相同,则外围电子排布图为: ,故A正确;
,故A正确;
B.NaCl为氯化钠的化学式,氯化钠属于离子化合物,不存在氯化钠分子,故B错误;
C.N原子核外有7个电子,N的基态原子核外电子排布式:lS22S22p3,故C正确;
D.氯原子最外层电子数是7,形成1个共价键,氧原子最外层电子数为6,形成2个共价键,次氯酸分子中氧原子与氢原子、氯原子之间分别形成1对共用电子对,次氯酸电子式为 ,结构式:H-O-Cl,故D正确;
,结构式:H-O-Cl,故D正确;
故选B.
点评 本题考查化学用语的书写,侧重考查学生对知识的迁移应用、分析解决问题的能力,注意对知识的全面掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:Na+、Fe2+、Cl-、SO42- | |
| B. | 在酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| C. | 在碱性溶液中:K+、Ba2+、SO42-、NO3- | |
| D. | 在含大量Mg2+的溶液中:Na+、NH4+、SO42-、Cl- |
4.下列各组物质,按照化合物、单质、混合物顺序排列的是( )
| A. | 干冰、铝粉、漂白粉 | B. | 生石灰、臭氧、熟石灰 | ||
| C. | 烧碱、液态氧、酒精 | D. | 铁红、晶体硅、胆矾 |
1.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
8.一定条件下,将1mol A和3mol B充入恒容密闭容器中,发生如下反应:A(g)+3B(g)?2C(s),下列不能说明该反应已经达到平衡状态的是( )
| A. | 气体的密度不再改变 | |
| B. | 混合气体中A的体积分数不再变化 | |
| C. | 混合气体的总压不再变化 | |
| D. | 单位时间内生成a mol A,同时生成2a mol C |
2.NA为阿伏加德罗常数的数值.下列说法不正确的是( )
| A. | 标准状况下,2.24L甲烷中含氢原子数为0.4NA | |
| B. | 0.3molNO2与足量的水反应转移电子数为0.2NA | |
| C. | 1L0.1mol•L-1Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 5.6g铁完全溶于足量稀硝酸,转移电子数为0.3NA |
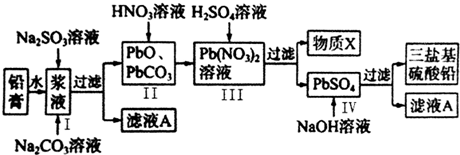

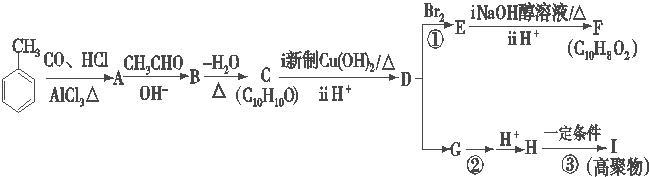
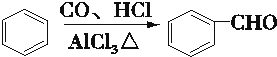
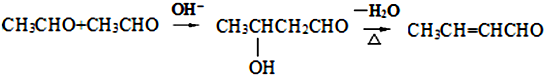
 .
. .
. .
.