题目内容
14.下列各项中表达正确的是( )| A. | N2的电子式: | B. | 二氧化碳分子的结构式为 O-C-O | ||
| C. | CH4分子的比例模型: | D. | F-的结构示意图: |
分析 A.氮气分子中,N原子最外层达到8电子稳定结构;
B.二氧化碳分子中含有两个碳氧双键;
C. 为球棍模型,比例模型主要体现出各原子的相对体积大小;
为球棍模型,比例模型主要体现出各原子的相对体积大小;
D.氟离子的核电荷数为9,最外层达到8电子稳定结构.
解答 解:A.氮气分子中含有氮氮三键,N原子最外层含有8个电子,氮气正确的电子式为 ,故A错误;
,故A错误;
B.二氧化碳分子中含有两个碳氧双键,为直线型结构,其正确的结构式为:O=C=O,故B错误;
C. 表示的是球棍模型,CH4分子的比例模型
表示的是球棍模型,CH4分子的比例模型 ,故C错误;
,故C错误;
D.氟离子的核外电子总数为10,其离子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及电子式、比例模型与球棍模型、离子结构示意图、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
5.化学用语是学习化学的重要工具,下列说法正确的是( )
| A. | 电解饱和食盐水,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| B. | 外加电流的金属保护中,被保护的金属与电源的正极相连,发生氧化反应 | |
| C. | 粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
2.等物质的量浓度的下列溶液混合后,所得溶液呈中性的是( )
| A. | 20mLNH3•H2O与20mLH2SO4 | B. | 10mLCa(HCO3)2与10mLNaOH | ||
| C. | 20mLNaHCO3与10mLCa(OH)2 | D. | 20mLNaHSO4与10mLBa(OH)2 |
6.常温下有以下体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=4的NaOH溶液,下列说法正确的是( )
| A. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| B. | ②和③混合,所得混合溶液的pH大于7 | |
| C. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| D. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
3.下列关于铅蓄电池的说法正确的是( )
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
4.下列分子中的14个碳原子一定会处于同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
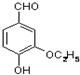 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.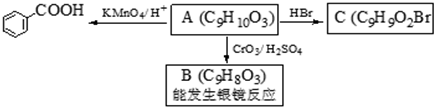
 .
. .
.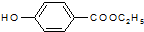 )是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).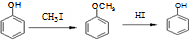
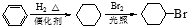
 .
.