题目内容
9.已知①氯水和溴水能将Fe2+氧化成Fe3+,而碘水不能;②Fe3+可以使KI-淀粉试液变蓝色.(1)向含1molFeI2的溶液中通入1molCl2,写出反应的离子方程式Cl2+2I-=I2+2Cl-.向该溶液中至少通入1.5molCl2,Fe2+、I-全部被被氧化.
(2)向含1molFeBr2的溶液中通入1molCl2,写出反应的离子方程式2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+
(3)向100mlFeBr2溶液中通入标况下体积为3.36L的Cl2,充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为2mol/L;
(4)向含1molFeI2和2molFeBr2的溶液中通入3molCl2后,溶液中所含各种离子的个数之比是Fe3+:Cl-:Br-=1:2:1;
(5)向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,若要保证溶液中含有两种阳离子,c的取值范围是a<c<(1.5a+0.5b).
分析 (1)氯气与碘离子反应生成氯离子和单质碘,根据反应方程式计算;
(2)1molFeBr2的溶液中通入1molCl2,先与亚铁离子反应,再与溴离子反应;
(3)还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br-的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-没有反应,溶液中n(Br-)=0.3mol,则n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,表示出参加反应的n(Br-),根据电子转移守恒列方程计算x值,再根据c=$\frac{n}{V}$计算;
(4)与相同氧化剂反应时,还原性越强的离子越先参加氧化还原反应,根据其还原能力大小顺序知,离子被氧化顺序是I->Fe2+>Br-,再结合氧化还原反应分析解答;
(5)要保证溶液中含有两种阳离子,则亚铁离子被氧化,且只能部分被氧化,则碘离子完全反应,溴离子不参与反应,据此进行讨论.
解答 解:(1)向含1molFeI2的溶液中通入1molCl2,氯气与碘离子反应生成氯离子和单质碘,则反应的离子方程式为:Cl2+2I-=I2+2Cl-;Fe2+、I-全部被被氧化,发生反应为:2FeI2+3Cl2=2FeCl3+2I2,则1molFeI2需要1.5mol氯气;
故答案为:Cl2+2I-=I2+2Cl-;1.5;
(2)1molFeBr2的溶液中通入1molCl2,先与亚铁离子反应,再与溴离子反应,其反应的离子方程式为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;
故答案为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;
(3)还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br- 的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-没有反应,n(Br-)=0.3mol,则n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得:x=0.2 mol,
所以原FeBr2溶液的物质的量浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:2mol/L;
(4)与相同氧化剂反应时,还原性越强的离子越先参加氧化还原反应,根据其还原能力大小顺序知,离子被氧化顺序是I->Fe2+>Br-,溶液中n(I-)=2mol,n(Fe2+)=3mol,n(Br-)=4mol,I-优先反应,其次是Fe2+,最后是Br-,
Cl2 +2I-=I2+2Cl-
1mol 2mol 2mol
1mol 2mol 2mol
2Fe2++Cl2 =2Fe3++2Cl-
2mol 1mol 2mol
3mol 1.5mol 3mol
2Br-+Cl2=2Cl-+Br2
2mol 1mol 2mol
1mol 0.5mol 1mol
通过以上分析知,I-、Fe2+完全被氧化,Br-有3mol被氧化,根据方程式知,溶液中存在的离子是:Fe3+、Br-、Cl-,
根据原子守恒知,n(C1-)=3n( Cl2)=6mol,n(Br-)=3mol,n(Fe3+)=3mol,
溶液溶液中各种离子物质的量之比为:n(Fe3+):n(Br-):n(C1-)=3mol:3mol:6mol=1:1:2,
故答案为:n(Fe3+):n(Br-):n(C1-)=1:1:2;
(5)向含和溶液中通入c mol Cl2,若要保证溶液中含有两种阳离子,说明反应后溶液中含有铁离子和亚铁离子,即:亚铁离子只能部分被氧化,根据还原性I->Fe2+>Br-可知,I-完全被氧化,Fe2+部分被氧化,Br-没有参与反应,
a molFeI2中含有2amolI-、amolFe2+,bmol FeBr2中含有bmolFe2+,故溶液中总共含有(a+b)molFe2+,
根据反应Cl2+2I-=I2+2Cl-、2Fe2++Cl2=2Fe3++2Cl-可知,氧化2amol碘离子需要消耗amol氯气,氧化(a+b)molFe2+,需要消耗0.5(a+b)mol氯气,
当溶液中铁离子和亚铁离子同时存在时,即亚铁离子部分被氧化,氯气的物质的量范围为:a<c<(1.5a+0.5b),
故答案为:a<c<(1.5a+0.5b).
点评 本题考查了氧化还原反应的计算、有关范围讨论的计算,题目难度中等,明确粒子氧化性、还原性强弱为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | O4的摩尔质量是64 g | |
| B. | O4与O2互为同位素 | |
| C. | O4与O3、O2都是氧元素的同分异构体 | |
| D. | 相同质量的O4与O3所含原子个数之比为1:1 |
| A. | N2的电子式: | B. | 二氧化碳分子的结构式为 O-C-O | ||
| C. | CH4分子的比例模型: | D. | F-的结构示意图: |
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ |

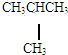
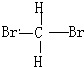 和
和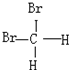 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4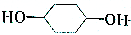 的路线如下图所示.
的路线如下图所示.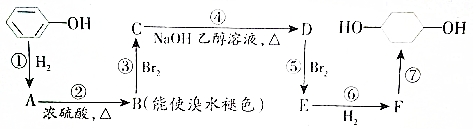
 ,F
,F .
. .
. .
.