题目内容
2.等物质的量浓度的下列溶液混合后,所得溶液呈中性的是( )| A. | 20mLNH3•H2O与20mLH2SO4 | B. | 10mLCa(HCO3)2与10mLNaOH | ||
| C. | 20mLNaHCO3与10mLCa(OH)2 | D. | 20mLNaHSO4与10mLBa(OH)2 |
分析 一般来说,强酸或强酸的酸式盐与强碱混合,如存在n(H+)=n(OH-),则混合后呈中性,以此解答该题.
解答 解:A.NH3•H2O为弱电解质,与硫酸混合,溶液呈酸性,故A错误;
B.10mLCa(HCO3)2与10mLNaOH混合,反应后生成碳酸钙和碳酸钠,溶液呈碱性,故B错误;
C.20mLNaHCO3与10mLCa(OH)2混合,反应后生成碳酸钙和碳酸钠,溶液呈碱性,故C错误;
D.20mLNaHSO4与10mLBa(OH)2混合,反应后生成硫酸钡和硫酸钠,溶液呈中性,故D正确.
故选D.
点评 本题考查了水的电离、溶液pH的计算计算,为高频考点,题目难度中等,注意掌握溶液酸碱性的判断方法,明确溶液酸碱性取决于氢离子与氢氧根离子浓度大小.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列各项中表达正确的是( )
| A. | N2的电子式: | B. | 二氧化碳分子的结构式为 O-C-O | ||
| C. | CH4分子的比例模型: | D. | F-的结构示意图: |
11.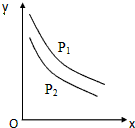 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
12.下列说法不正确的是( )
| A. | 硅胶可用作食品干燥剂 | |
| B. | 蚕丝、人造丝充分水解后均可得倒氨基酸 | |
| C. | 海水提溴过程中有氧化还原反应发生 | |
| D. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 |
 我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):


 2012年夏,发生在多地的暴雨共造成亿万人受灾.水是组成生命体的重要化学物质,也是一种重要的溶剂,同时也是参与化学反应的重要试剂.怎样利用水为百姓造福将是今后研究的重要课题.请回答下列问题:
2012年夏,发生在多地的暴雨共造成亿万人受灾.水是组成生命体的重要化学物质,也是一种重要的溶剂,同时也是参与化学反应的重要试剂.怎样利用水为百姓造福将是今后研究的重要课题.请回答下列问题: