题目内容
2.下列有关化学用语正确的是( )| A. | CO2的结构式:O-C-O | B. | 羟基的电子式: | ||
| C. | NH3分子比例模型: | D. | Cl-的结构示意图: |
分析 A.二氧化碳分子中含有两个碳氧双键;
B.羟基为中性原子团,氧原子最外层含有7个电子;
C.比例模型主要体现出各原子的相对体积大小;
D.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构.
解答 解:A.二氧化碳分子为直线型结构,分子中含有两个碳氧双键,其正确的结构式为:O=C=O,故A错误;
B.羟基是电中性的原子团,氧原子周围多1个电子,羟基电子式为 ,故B错误;
,故B错误;
C.题中为球棍模型,氨气分子正确的比例模型为: ,故C错误;
,故C错误;
D.氯离子的核电荷数为17,最外层达到8电子稳定结构,其离子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及比例模型与球棍模型、结构式、离子结构示意图、电子式等知识,注意掌握常见化学用语的概念及正确表示方法,试题培养了学生的规范答题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.向等物质的量浓度的NaOH和Na2S的混合溶液中加入稀硫酸,下列离子方程式与事实不相符的是( )
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
14.一定温度下,反应2NO+O2?2NO2在容积不变的密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 升高反应温度 | B. | 保持容积不变,充入NO2 | ||
| C. | 保持容积不变,充入He | D. | 保持压强不变,充入He |
11.运用元素周期律分析下列推断,其中错误的是( )
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
12. 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )| A. | A点时pH=1 | |
| B. | 恰好完全沉淀时Ba(OH)2溶液的体积为2L | |
| C. | B点时,溶液中的离子浓度关系为c(Na+)>c(SO42-)>c(H+)=c(OH-) | |
| D. | C点时pH=14 |
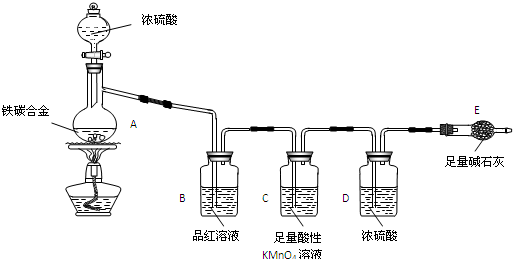
 .
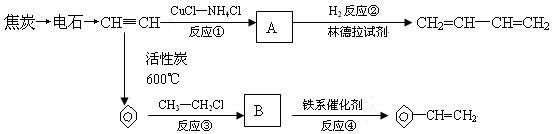
. 、
、 .
. Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行: