题目内容
18.下列各溶液中,微粒的物质的量浓度关系不正确的是( )| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32?)+c(H2CO3) | |
| C. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 A.弱碱存在电离平衡,氨水平衡状态下氢氧根离子浓度和盐酸溶液中氢离子浓度相同,反应后又继续电离出氢氧根离子,溶液显碱性;
B.碳酸钠溶液中组成物料守恒钠元素和碳元素相同,n(Na)=n(C);
C.氯化铵溶液中铵根离子水解,导致铵根离子浓度减小;
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,依据溶液中电荷守恒分析判断.
解答 解:A.弱碱存在电离平衡,氨水平衡状态下氢氧根离子浓度和盐酸溶液中氢离子浓度相同,反应后又继续电离出氢氧根离子,溶液显碱性,c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.碳酸钠溶液中组成物料守恒钠元素和碳元素相同,即满足物料守恒:n(Na)=n(C),0.1 mol•L-1 Na2CO3溶液:c(Na+)=2[c(HCO3-)+c(CO32?)+c(H2CO3)],故B错误;
C.氯化铵溶液中铵根离子水解溶液显酸性,则c(NH4+)<c( Cl-),故C错误;
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),结合c(H+)>c(OH-)可知:c(Na+)<c(CH3COO-),离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确;
故选BC.
点评 本题考查了电解质溶液中离子浓度大小比较,题目难度中等,注意根据电荷守恒、物料守恒及盐类水解原理进行分析,A为易错点,注意混合液中氨水过量,溶液呈碱性.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
8.下列有机反应属于加成反应的是( )
| A. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | CH3CH2OH+CH3C00H$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2═CH2+Br2→BrCH2CH2Br |
9.某体系中的物质有HCl、NaCl、FeCl2、H2O、NaNO3、FeCl3、NO,FeCl2为反应物,则下列有关说法正确的是( )
| A. | NO在反应中作还原剂 | |
| B. | 氧化剂和还原剂的物质的量比为1:3 | |
| C. | FeCl2发生还原反应 | |
| D. | 0.5molFeCl2发生反应,转移电子1.5mol |
6.下列说法正确的是( )
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第ⅠA族元素比第ⅡA族元素的金属性强 | |
| C. | 随着核电荷数的递增,卤族元素的气态氢化物的稳定性逐渐减弱 | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强. |
3.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.
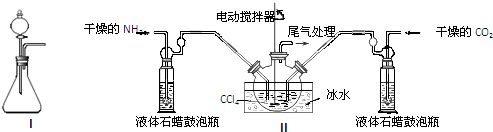
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品6.58g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为3.94g.则样品中氨基甲酸铵的质量分数为76%..
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.

注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
10.向等物质的量浓度的NaOH和Na2S的混合溶液中加入稀硫酸,下列离子方程式与事实不相符的是( )
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
8.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
 Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行: