题目内容
20.用铂电极(惰性)电解下列溶液时,阴极和阳极的主要产物分别是H2和O2的是( )| A. | 稀KOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |
分析 根据用惰性电解下列溶液,阴极和阳极上的主要产物为分别为H2和O2时,说明电解的实质是电解水,根据电解原理知识来回答.
解答 解:A、电解氢氧化钾阳极上产生O2,阴极上产生H2,是电解水型的,故A正确;
B、电解盐酸在阳极产生氯气,在阴极产生氢气,属于电解电解质型的,故B错误;
C、电解硫酸铜在阳极上产生氧气,阴极上产生金属铜,是放氧生酸型的,故C错误;
D、电解氯化钠溶液在阳极上产生氯气,阴极上产生氢气,是放氢生碱型的,故D错误;
故选A.
点评 本题考查学生电解类型的有关知识,可以根据电解池的工作原理来回答,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
10.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下

根据上述实验,下列说法正确的是( )

根据上述实验,下列说法正确的是( )
| A. | 气体1可能为NO和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
8.下列有机反应属于加成反应的是( )
| A. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | CH3CH2OH+CH3C00H$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2═CH2+Br2→BrCH2CH2Br |
15.如图为铜铁原电池示意图,心里有关说法正确的是( )


| A. | 电子由铁棒通过导线流向铜棒 | B. | 正极反应为Fe-2e-═Fe2+ | ||
| C. | 铜棒逐渐溶解 | D. | 该装置能将电能转化为化学能 |
5.已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=akJ•mol-1,平衡常数为K测得在不同温度下,K值如下:
(1)写成该反应的平衡常数表达式$\frac{[CO]}{[C{O}_{2}]}$.
(2)该反应为吸热(选填“吸热”或“放热”)反应.
(3)700℃时反应达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO2C.升高温度到900℃D.使用合适的催化剂 E.增加Fe的量
(4)下列图象符合该反应的是A(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2).

| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)该反应为吸热(选填“吸热”或“放热”)反应.
(3)700℃时反应达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO2C.升高温度到900℃D.使用合适的催化剂 E.增加Fe的量
(4)下列图象符合该反应的是A(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2).

9.某体系中的物质有HCl、NaCl、FeCl2、H2O、NaNO3、FeCl3、NO,FeCl2为反应物,则下列有关说法正确的是( )
| A. | NO在反应中作还原剂 | |
| B. | 氧化剂和还原剂的物质的量比为1:3 | |
| C. | FeCl2发生还原反应 | |
| D. | 0.5molFeCl2发生反应,转移电子1.5mol |
10.向等物质的量浓度的NaOH和Na2S的混合溶液中加入稀硫酸,下列离子方程式与事实不相符的是( )
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
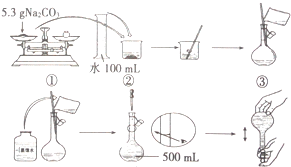 某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:
某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示: