题目内容
海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等方面.如图1是从含碘CCl4溶液得到碘的实验过程:
完成下列填空:
①向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为 ;该操作将I2还原为I-的目的是 .
②操作X的名称为 ,所用的主要仪器是 .
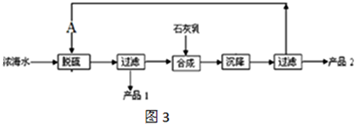
③氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图2所示).
实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 .
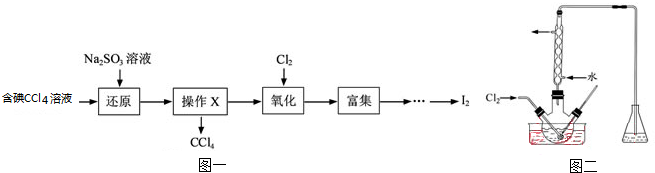
④已知:5SO32-+2IO3-+2H+→I2+5SO42-+H2O,某含碘溶液(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种.请补充完整检验含碘溶液中是否同时含有I-、IO3-的实验方案: .
实验中可供选择的试剂:CCl4、稀盐酸、淀粉溶液
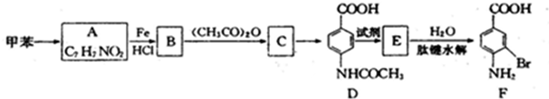
⑤浓海水提取镁的工艺流程如图3:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 .1L浓海水最多可得到产品2的质量为 g.
完成下列填空:
①向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为
②操作X的名称为
③氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图2所示).
实验控制在较低温度下进行的原因是

④已知:5SO32-+2IO3-+2H+→I2+5SO42-+H2O,某含碘溶液(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种.请补充完整检验含碘溶液中是否同时含有I-、IO3-的实验方案:
实验中可供选择的试剂:CCl4、稀盐酸、淀粉溶液
⑤浓海水提取镁的工艺流程如图3:
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |

考点:海水资源及其综合利用
专题:实验设计题,元素及其化合物
分析:①碘具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,自身被还原生成碘离子;将碘还原为碘离子,目的是利用分液法除去四氯化碳;
②分离互不相溶的液体采用分液方法;使用的仪器是分液漏斗;
③碘不稳定,易升华,且温度高时气体难溶解;碘能和强碱溶液反应;
④先用四氯化碳溶液萃取含碘溶液然后分液,水层用淀粉溶液检验不出碘时,然后取水层溶液,向溶液中加入淀粉试液,再加盐酸酸化,根据溶液是否变蓝色判断;
⑤工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量.
②分离互不相溶的液体采用分液方法;使用的仪器是分液漏斗;
③碘不稳定,易升华,且温度高时气体难溶解;碘能和强碱溶液反应;
④先用四氯化碳溶液萃取含碘溶液然后分液,水层用淀粉溶液检验不出碘时,然后取水层溶液,向溶液中加入淀粉试液,再加盐酸酸化,根据溶液是否变蓝色判断;
⑤工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量.
解答:
解:①碘具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,自身被还原生成碘离子,离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+;将碘还原为碘离子,目的是利用分液法除去四氯化碳,所以该操作将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液,
故答案为:SO32-+I2+H2O=2I-+SO42-+2H+;将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液;
②分离互不相溶的液体采用分液方法,分离四氯化碳和水溶液采用分液方法,所以X操作为分液;使用的仪器是分液漏斗,故答案为:分液;分液漏斗;
③碘不稳定,易升华,且温度高时气体难溶解,所以温度较低的原因是:防止碘升华或者被氧化、增大氯气溶解度;碘能和强碱溶液反应,锥形瓶中液体是NaOH溶液,
故答案为:防止碘升华或者被氧化、增大氯气溶解度;NaOH溶液;
④先用四氯化碳溶液萃取含碘溶液然后分液,水层用淀粉溶液检验不出碘时,然后取水层溶液,向溶液中加入淀粉试液,再加盐酸酸化,如果有碘离子和碘酸根离子,二者发生氧化还原反应生成碘单质,淀粉试液变蓝色,否则不同时含有碘离子和碘酸根离子,
故答案为:取少量含碘溶液用四氯化碳多次萃取、分液;水层用淀粉溶液检验不出碘单质时,水层取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化,若溶液变蓝,说明废水中含有碘离子和碘酸根粒子,如果溶液不变蓝,说明不同时含有碘离子和碘酸根离子;
⑤工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
=69.6g,
故答案为:Ca2++SO42-=CaSO4↓;Mg(OH)2;69.6.
故答案为:SO32-+I2+H2O=2I-+SO42-+2H+;将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液;
②分离互不相溶的液体采用分液方法,分离四氯化碳和水溶液采用分液方法,所以X操作为分液;使用的仪器是分液漏斗,故答案为:分液;分液漏斗;
③碘不稳定,易升华,且温度高时气体难溶解,所以温度较低的原因是:防止碘升华或者被氧化、增大氯气溶解度;碘能和强碱溶液反应,锥形瓶中液体是NaOH溶液,
故答案为:防止碘升华或者被氧化、增大氯气溶解度;NaOH溶液;
④先用四氯化碳溶液萃取含碘溶液然后分液,水层用淀粉溶液检验不出碘时,然后取水层溶液,向溶液中加入淀粉试液,再加盐酸酸化,如果有碘离子和碘酸根离子,二者发生氧化还原反应生成碘单质,淀粉试液变蓝色,否则不同时含有碘离子和碘酸根离子,
故答案为:取少量含碘溶液用四氯化碳多次萃取、分液;水层用淀粉溶液检验不出碘单质时,水层取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化,若溶液变蓝,说明废水中含有碘离子和碘酸根粒子,如果溶液不变蓝,说明不同时含有碘离子和碘酸根离子;
⑤工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
| 58g |
| 24g |
故答案为:Ca2++SO42-=CaSO4↓;Mg(OH)2;69.6.
点评:本题考查海水资源综合利用,涉及物质的提纯和分离、氧化还原反应、计算等知识点,知道流程图中发生的反应及基本操作,会根据物质的性质设计实验,难点是④,注意化学语言的准确性,题目难度中等.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、用醋酸溶液除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向FeBr2溶液中通入足量Cl2:Fe3++2Br-+Cl2═Fe3++Br2+2Cl- |
| C、向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3- |
| D、向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
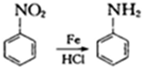
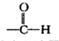 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位
 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题:
 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从 到
到 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件). ;
; .
.

