题目内容
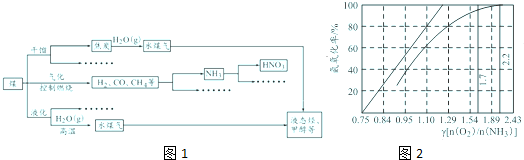
开发氢能是实现社会可持续发展的需要.如图1是以含H2S杂质的天然气为原料制取氢气的流程图.

回答下列问题:
(1)反应②的化学方程式为 .
(2)反应④的离子方程式为 .
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.4kJ?mol-1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ?mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号).
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量.若1.00mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO的转化率为 .
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00m3 天然气理论上可制得氢气 m3(同温同压条件下).
(4)一定条件下,如图2所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物).
①生成目标产物的电极反应式为 .
②该储氢装置的电流效率为η= .
(η=
×100%,计算结果保留小数点后1位)

回答下列问题:
(1)反应②的化学方程式为
(2)反应④的离子方程式为
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.4kJ?mol-1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ?mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量.若1.00mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO的转化率为
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00m3 天然气理论上可制得氢气
(4)一定条件下,如图2所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物).
①生成目标产物的电极反应式为
②该储氢装置的电流效率为η=
(η=
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,化学反应速率的影响因素,化学平衡的计算
专题:
分析:(1)根据图1可知,O2将NH4HS中的S元素氧化为S单质,据此写出化学方程式;
(2)SO2将I2还原为HI,而I2将SO2氧化为H2SO4,据此写出离子方程式;
(3)①反应①是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大,依据平衡移动原理和影响反应速率因素分析判断;
②依据化学平衡三段式列式计算,转化率=
×100%计算;
③天然气中硫化氢的体积分数为5%,可得甲烷的体积,然后根据转化率为80%,结合化学方程式得出生成的氢气的体积;
(4)①该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
②阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
(2)SO2将I2还原为HI,而I2将SO2氧化为H2SO4,据此写出离子方程式;
(3)①反应①是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大,依据平衡移动原理和影响反应速率因素分析判断;
②依据化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
③天然气中硫化氢的体积分数为5%,可得甲烷的体积,然后根据转化率为80%,结合化学方程式得出生成的氢气的体积;
(4)①该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
②阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答:
解:(1)根据图1可知,O2将NH4HS中的S元素氧化为S单质,S将氧气还原为-2价,根据得失电子数守恒将反应配平,得化学方程式:2NH4HS+O2═2NH3?H2O+2S↓,
故答案为:2NH4HS+O2═2NH3?H2O+2S↓;
(2)SO2将I2还原为HI,而I2将SO2氧化为H2SO4,故化学方程式为:SO2+I2+2H2O═H2SO4+2HI,离子方程式为:SO2+I2+2H2O═4H++SO42-+2I-;
(3)①反应①CH4(g)+H2O(g)?CO2(g)+3H2(g)△H=+206.4 kJ?mol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;
a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大,故a正确;
b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H2百分含量不一定增大,故b错误;
c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c错误;
d.降低压强,平衡向着正向移动,氢气百分含量减小,但反应速率减慢,故d错误;
故选a;
②利用反应②,将CO进一步转化,可提高H2产量,若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ?mol-1
起始量(mol) 0.2 0.18+x 0 0.8
变化量(mol) x x x x
平衡量(mol)0.2-x 0.18 x x+0.8
则0.2-x+x+x+0.8=1.18
x=0.18
则CO转化率为
×100%=90%
故答案为:90%;
③天然气中硫化氢的体积分数为5%,故1.00m3 天然气中甲烷的体积为0.95m3 天然气,由于转化率为80%,设生成的氢气的体积为Xm3,
可有:CH4(g)+2H2O(g)?CO2(g)+4H2(g)
1 4
0.95m3×80% X
解得
=
解得X=3.04
故答案为:3.04;
(4)①该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12;
②阳极上氢氧根离子放电生成氧气,阳极上生成3.4mol氧气转移电子的物质的量=3.4mol×4=13.6mol,
生成1mol氧气时生成2mol氢气,则生成3.4mol氧气时同时生成6.8mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×25%-xmol,反应后苯的含量=
×100%=10%,
x=1.17,苯转化为环己烷转移电子的物质的量为1.17mol×6=7.02mol,则
×100%=51.6%,
故答案为:51.6%.
故答案为:2NH4HS+O2═2NH3?H2O+2S↓;
(2)SO2将I2还原为HI,而I2将SO2氧化为H2SO4,故化学方程式为:SO2+I2+2H2O═H2SO4+2HI,离子方程式为:SO2+I2+2H2O═4H++SO42-+2I-;
(3)①反应①CH4(g)+H2O(g)?CO2(g)+3H2(g)△H=+206.4 kJ?mol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;
a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大,故a正确;
b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H2百分含量不一定增大,故b错误;
c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c错误;
d.降低压强,平衡向着正向移动,氢气百分含量减小,但反应速率减慢,故d错误;
故选a;
②利用反应②,将CO进一步转化,可提高H2产量,若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ?mol-1
起始量(mol) 0.2 0.18+x 0 0.8
变化量(mol) x x x x
平衡量(mol)0.2-x 0.18 x x+0.8
则0.2-x+x+x+0.8=1.18
x=0.18
则CO转化率为
| 0.18mol |
| 0.2mol |
故答案为:90%;
③天然气中硫化氢的体积分数为5%,故1.00m3 天然气中甲烷的体积为0.95m3 天然气,由于转化率为80%,设生成的氢气的体积为Xm3,
可有:CH4(g)+2H2O(g)?CO2(g)+4H2(g)
1 4
0.95m3×80% X
解得
| 1 |
| 0.95m3×80% |
| 4 |
| X |
解得X=3.04
故答案为:3.04;
(4)①该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12;
②阳极上氢氧根离子放电生成氧气,阳极上生成3.4mol氧气转移电子的物质的量=3.4mol×4=13.6mol,
生成1mol氧气时生成2mol氢气,则生成3.4mol氧气时同时生成6.8mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×25%-xmol,反应后苯的含量=
| 10mol×25%-X |
| 10mol-3Xmol+6.8mol |
x=1.17,苯转化为环己烷转移电子的物质的量为1.17mol×6=7.02mol,则
| 7.02mol |
| 13.6mol |
故答案为:51.6%.
点评:本题考查了电解池原理的应用,侧重于电极的判断、电极方程的书写以及电子守恒在计算中的应用的考查,题目难度中等.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、H7N9型禽流感是一种新型禽流感,流感病毒通常检测方法是基于核酸检测的原理.核酸一种是蛋白质 |
| B、侯德榜发明了侯氏制碱法、维勒用氮气和氢气合成了氨气、阿伦尼乌斯创立了电离学说、扫描隧道显微镜的发明和STM技术应用等等,这些都对化学学科的应用和发展作出了重要的贡献 |
| C、使用可再生资源、注重原子的经济性、推广利用二氧化碳与环氧丙烷生成的生物降解材料等都是绿色化学的内容 |
| D、化学帮助人类创造和合成了大量材料,如高纯硅制作太阳能电池、聚氯乙烯塑料用来食品包装、人造刚玉Al2O3用作耐高温材料等等 |
化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是( )
| A、为提高农作物的产量和质量,应大量使用化肥和农药 |
| B、装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| C、氯气本身有毒,可以直接杀死水中的细菌和病毒,所以液氯可用于自来水的消毒剂 |
| D、棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O |
下列试剂用自来水配制不会导致药品变质的是( )
| A、硝酸银 | B、氯化钠 |
| C、亚硫酸钠 | D、硫代硫酸钠 |
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应.下列说法正确的是( )
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g)?2W(g).平衡时W的体积分数随温度和压强的变化如下表所示:下列说法正确的是( )
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |