题目内容
11.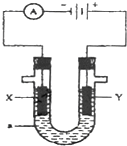 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是NaOH溶液,
①电解池中X极上的电极反应式为H+-2e-=H2
②电解后溶液PH的变化为变大(变大、不变或变小)
(2)若X、Y都是惰性电极,a是 H2SO4是溶液,
①电解池中Y电极上的电极反应式为4OH--4e-=O2+2H2O
②电解后溶液PH的变化为变小(变大、不变或 变小)
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是精铜,
②Y电极的材料是粗铜,电极反应式为Cu-2e-=Cu2+.
分析 (1)若X、Y都是惰性电极,a是NaOH溶液,阳极发生4OH--4e -=O2+2H2O;阴极发生2H++2e-=H2↑;
(2)若X、Y都是惰性电极,a是 H2SO4是溶液,阳极发生4OH--4e -=O2+2H2O;阴极发生2H++2e-=H2↑;
(3)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极.
解答 解:(1)X、Y都是惰性电极,a是NaOH溶液,
①电解池中X为阴极,发生H+-2e-=H2,故答案为:H+-2e-=H2;
②阳极生成氧气,阴极生成氢气,实际上为电解水,溶液浓度增大,则pH变大,故答案为:变大;
(2)若X、Y都是惰性电极,a是 H2SO4是溶液,
①电解池中Y电极为阳极,发生氧化反应,电极方程式为4OH--4e -=O2+2H2O,故答案为:4OH--4e -=O2+2H2O;
②阳极生成氧气,阴极生成氢气,实际上为电解水,溶液浓度增大,则pH变小,故答案为:变小;
(3)①电解方法精炼粗铜,电解池的阴极材料是精铜,故答案为:精铜;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+.
点评 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
相关题目
19.H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ•mol-1,已知:断裂1mol H-H键需要吸收b kJ的能量,断裂1mol I-I键需要吸收c kJ的能量(a、b、c均大于零)下列说法不正确的是( )
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1mol H-H键和1 mol I-I键所需能量大于断开2mol H-I键所需能量 | |
| C. | 断开2mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ |
3.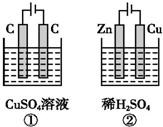 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 产生气体的总体积:①>② | |
| B. | 电极上析出物质的总质量:②>① | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | ①中阳极的电极反应式:4OH--4e-═2H2O+O2↑;②中阴极的电极反应式:2H++2e-═H2↑ |
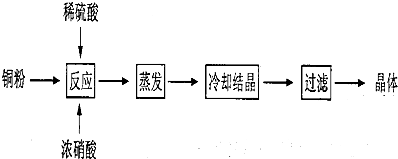
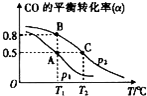 SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
