题目内容
19.H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ•mol-1,已知:断裂1mol H-H键需要吸收b kJ的能量,断裂1mol I-I键需要吸收c kJ的能量(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1mol H-H键和1 mol I-I键所需能量大于断开2mol H-I键所需能量 | |
| C. | 断开2mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ |
分析 A、依据反应是放热反应,结合能量守恒分析;
B、断裂化学键吸收能量,形成化学键放出能量,结合反应是放热反应分析判断;
C、依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
D、反应是可逆反应不能进行彻底.
解答 解:A、H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ•mol-1 ,反应是放热反应,反应物能量高于生成物,故A正确;
B、断裂化学键吸收能量,形成化学键放出能量,反应是放热反应所以形成化学键放出的能量大于断裂化学键吸收的能量,断开1mol H-H键和1mol I-I键所需能量小于断开2mol H-I键所需能量,故B错误;
C、△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故C正确;
D、反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D正确;
故选B.
点评 本题考查了化学反应的焓变分析,化学键与焓变关系的计算分析应用,掌握原理和基础是解题关键,题目难度中等.

练习册系列答案
相关题目
9.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |
10.干冰不能用来扑灭镁条火灾,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
7.下列说法正确的是( )
| A. | 往NaHC2O4溶液中通入氨气至中性:c(H2C2O4)+c(NH4+)>c(C2O42-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 | |
| C. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后过滤,所得滤液中存在:c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 在同浓度的HCN和NaCN的混合溶液中,若pH>7,则c(HCN)<c(Na+) |
14.下列反应中,既属于氧化还原反应,又属于离子反应的是( )
| A. | 钠与水的反应 | |
| B. | 灼热的炭与二氧化碳反应生成一氧化碳 | |
| C. | 高炉炼铁 | |
| D. | 氢氧化钠溶液与稀盐酸的反应 |
4.汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1,在一容积为5L的恒容密闭容器中充人0.2mol NO和0.5mol CO,5min后该反应达到平衡,此时N2的物质的量为0.06mol.下列说法正确的是( )
| A. | 达到平衡后,若只升高温度,化学平衡正向移动 | |
| B. | 达到平衡后,再通入稀有气体,逆反应速率增大 | |
| C. | 使用催化剂,平衡常数不变 | |
| D. | 0~5 min内,NO的反应速率为2.4×1 0-3 mol•L-1•min-1 |
9.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气中含有2NA个氢原子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol/L |
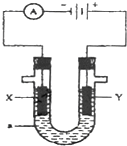 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: