题目内容
6. SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.(1)上述四种气体中直接排入空气时不会引起酸雨的有CO(填化学式);
(2)已知:2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)═2NO2(g);△H=-113.0kJ/mol
请写出NO2 和SO2反应生成 SO3和NO的热化学方程式:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol
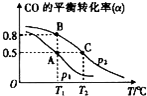
(3)CO可用于合成甲醇,其反应的化学方程式为:CO(g)+2H2(g)?CH3OH(g),在一容积可变的密闭容器中充有10mol CO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示.
①上述合成甲醇的反应为放热(填“放热”或“吸热”)反应;
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC;
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为2L.
分析 (1)二氧化硫及氮的氧化物会引起酸雨;
(2)已知:①.2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ/mol
②.O2(g)+2NO(g)═2NO2(g);△H=-113.0kJ/mol
根据盖斯定律,(①-②)÷2可得:SO2(g)+NO2(g)=SO3(g)+NO(g);
(3)①由图可知,压强一定时,随温度升高CO的转化率减小,说明升高温度平衡向逆反应方向移动;
②温度不变,化学平衡常数不变,温度升高平衡向逆反应方向移动,平衡常数减小,A、B两点温度相同,二者平衡常数相同;
③根据CO的转化率计算平衡时A中各组分物质的量,再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,A、B两点温度相同,二者平衡常数相同,结合B中CO转化率计算平衡时B中各组分物质的量,再根据平衡常数计算平衡时B容器的容积.
解答 解:(1)二氧化硫及氮的氧化物会引起酸雨,CO不能引起酸雨,故答案为:CO;
(2)已知:①.2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ/mol
②.O2(g)+2NO(g)═2NO2(g);△H=-113.0kJ/mol
根据盖斯定律,(①-②)÷2可得:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol,
故答案为:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol;
(3)①由图可知,随温度升高CO的转化率减小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,故答案为:放热;
②因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC,
故答案为:KA=KB>KC;
③T1时,A点对应的α=0.5,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1,A、B两点温度相同,二者平衡常数相同,
B中平衡时CO转化率为0.8,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):10 20 0
变化量(mol):8 16 8
平衡量(mol):2 4 8
设平衡时B容器的容积为VL,则:$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2,
故答案为:2.
点评 本题考查化学平衡计算、化学平衡图象、平衡常数应用、化学平衡影响因素等,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等,难度中等.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案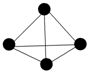 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子. N4分子结构如图,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N键放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子. N4分子结构如图,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N键放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )| A. | +882 kJ/mol | B. | +441 kJ/mol | C. | -882 kJ/mol | D. | -441 kJ/mol |
| A. | 钠与水的反应 | |
| B. | 灼热的炭与二氧化碳反应生成一氧化碳 | |
| C. | 高炉炼铁 | |
| D. | 氢氧化钠溶液与稀盐酸的反应 |
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
| A. | 漂白粉是混合物,有效成分是CaCl2 | |
| B. | 光照氯水有气泡逸出,该气体是Cl2 | |
| C. | Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 | |
| D. | 实验室用二氧化锰与浓盐酸反应制取Cl2 |
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═2H2O+O2↑ | |
| B. | 阴极:2H++2e-═H2↑阳极:2Cl--2e-═Cl2↑ | |
| C. | 阴极:Cu2++2e-═Cu阳极:4OH--4e-═2H2O+O2↑ | |
| D. | 阴极:Cu2++2e-═Cu阳极:2Cl--=2e-═Cl2↑ |
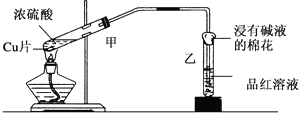
| A. | 甲试管内溶液变为蓝色 | |
| B. | 乙试管中品红溶液红色褪去 | |
| C. | 棉花上喷入的溶液可能为氢氧化钠溶液 | |
| D. | 棉花上喷入的溶液可能为饱和碳酸钠溶液 |

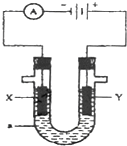 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: