题目内容
美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖.有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用.一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
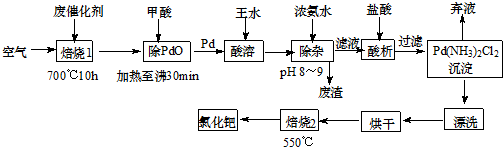
(1)甲酸在反应中的作用是 (选填:“氧化剂”或“还原剂”);
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式);
(3)王水是浓硝酸与浓盐酸按体积比1:3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成.
①气体B的化学式为 ,
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%.则A的化学式为 ;
(4)700℃“焙烧1”的目的是 ,550℃“焙烧2”的目的是 .

(1)甲酸在反应中的作用是
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是
(3)王水是浓硝酸与浓盐酸按体积比1:3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成.
①气体B的化学式为
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%.则A的化学式为
(4)700℃“焙烧1”的目的是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:废钯催化剂经烘干后,在700℃的高温下焙烧,C、Fe、Pd、有机物被氧气氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化铁反应生成盐和水,PdO和甲酸发生氧化还原反应生成Pd,滤渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同时生成气体,加入浓氨水调节溶液PH,钯转变为可溶性[Pd(NH3)4]2+,使铁全部沉淀,溶液中加入盐酸酸析得到沉淀,经过脱氨等一系列操作得当氯化钯.
(1)PdO和甲酸发生氧化还原反应生成Pd,Pb的化合价降低;
(2)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁;
(3)①王水是浓硝酸与浓盐酸按体积比1:3混合而成的,硝酸具有氧化性,被还原为NO;
②钯在王水中溶解的过程中有化合物A,A中含有的元素为H、Pb、Cl,Cl的百分含量为1-42.4%-0.8%=56.8%;
(4)流程分析,在700℃的高温下焙烧,Fe、有机物被氧气氧化生成氧化物,550℃焙烧2的目的是脱氨.
(1)PdO和甲酸发生氧化还原反应生成Pd,Pb的化合价降低;
(2)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁;
(3)①王水是浓硝酸与浓盐酸按体积比1:3混合而成的,硝酸具有氧化性,被还原为NO;
②钯在王水中溶解的过程中有化合物A,A中含有的元素为H、Pb、Cl,Cl的百分含量为1-42.4%-0.8%=56.8%;
(4)流程分析,在700℃的高温下焙烧,Fe、有机物被氧气氧化生成氧化物,550℃焙烧2的目的是脱氨.
解答:
解:废钯催化剂经烘干后,再在700℃的高温下焙烧,Fe、Pd、有机物被氧气氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化铁反应生成盐和水,PdO和甲酸发生氧化还原反应生成Pd,滤渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同时生成气体,加入浓氨水调节溶液PH沉淀铁离子,得到溶液中中加入盐酸酸析得到沉淀Pd(NH3)2Cl2 ,通过脱氨等一系列操作得当氯化钯.
(1)PdO和甲酸发生氧化还原反应生成Pd,Pb的化合价降低,甲酸作还原剂,故答案为:还原剂;
(2)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁,故答案为:Fe(OH)3;
(3)①王水是浓硝酸与浓盐酸按体积比1:3混合而成的,硝酸具有氧化性,被还原为无色有毒的气体NO,故答案为:NO;
②A中含有的元素为H、Pb、Cl,元素的质量分数分别为Pd:42.4%,H:0.8%,Cl:1-42.4%-0.8%=56.8%,故n(H):n(Pd):n(Cl)=
:
:
=2:1:4,故A的化学式为H2PdCl4,故答案为:H2PdCl4;
(4)在700℃的高温下焙烧,C、Fe,有机物被氧气氧化生成氧化物,除去活性炭和有机物;550℃焙烧2的目的是脱氨将Pd(NH3)2Cl2变化为PdCl2,故答案为:除去活性炭及有机物;脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”].
(1)PdO和甲酸发生氧化还原反应生成Pd,Pb的化合价降低,甲酸作还原剂,故答案为:还原剂;
(2)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁,故答案为:Fe(OH)3;
(3)①王水是浓硝酸与浓盐酸按体积比1:3混合而成的,硝酸具有氧化性,被还原为无色有毒的气体NO,故答案为:NO;
②A中含有的元素为H、Pb、Cl,元素的质量分数分别为Pd:42.4%,H:0.8%,Cl:1-42.4%-0.8%=56.8%,故n(H):n(Pd):n(Cl)=
| 0.8% |
| 1 |
| 42.4% |
| 207 |
| 56.8% |
| 35.5 |
(4)在700℃的高温下焙烧,C、Fe,有机物被氧气氧化生成氧化物,除去活性炭和有机物;550℃焙烧2的目的是脱氨将Pd(NH3)2Cl2变化为PdCl2,故答案为:除去活性炭及有机物;脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”].
点评:本题以Pd的提取为载体考查了工艺流程,涉及化学式的确定、氧化还原反应等知识点,明确物质的性质是解本题关键,注意从整体上分析分析解答,知道每一步涉及的反应、物质分离的方法等知识点,结合元素守恒分析解答,题目难度中等.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法或表示式正确的是( )
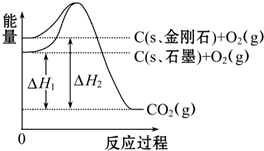

| A、C(s、石墨)═C(s、金刚石)△H=+1.9 kJ?mol-1 |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、1 mol石墨的能量比1 mol金刚石的总能量大 |
将Cl2通入NaOH溶液中,反应得到NaCl,NaClO3,NaClO的混合溶液,其中ClO-、ClO3-的浓度比为1:3,则Cl2与NaOH反应时,被还原的氯元素和被氧化的氯元素的物质的量的比是( )
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
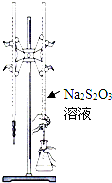 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
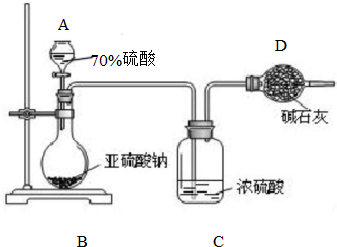 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验: 某有机物M的球棍模型如图所示:
某有机物M的球棍模型如图所示:
