题目内容
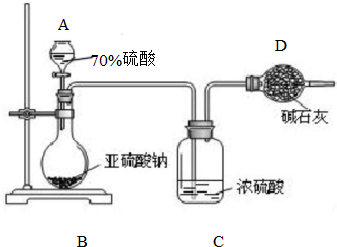 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:(1)实验仪器A的名称为
(2)装置C中浓硫酸的作用是
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为
(4)该实验方案存在明显缺陷,会使测定结果
考点:实验装置综合
专题:实验设计题
分析:(1)根据装置图分析;
(2)浓硫酸具有吸水性,作干燥剂;
(3)装置D中干燥管实验前后增重的质量为二氧化硫的质量,根据方程式求出亚硫酸钠的质量,再求出质量分数;
(4)空气中的二氧化碳和水蒸气进入D会使二氧化硫的质量偏大.
(2)浓硫酸具有吸水性,作干燥剂;
(3)装置D中干燥管实验前后增重的质量为二氧化硫的质量,根据方程式求出亚硫酸钠的质量,再求出质量分数;
(4)空气中的二氧化碳和水蒸气进入D会使二氧化硫的质量偏大.
解答:
解:(1)装置A是向烧瓶中加液体的仪器是分液漏斗;
故答案为:分液漏斗;
(2)浓硫酸具有吸水性,作干燥剂,用于干燥SO2气体,防止水蒸气和二氧化硫一起进入D,使二氧化硫的质量偏大;
故答案为:干燥SO2气体;
(3)装置D中干燥管实验前后增重的质量为二氧化硫的质量为4.8g,设亚硫酸钠为xg,
Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
126 64
xg 4.8g
x=
=9.45g,
则质量分数为
×100%=94.5%;
(4)空气中的二氧化碳和水蒸气进入D会使二氧化硫的质量偏大,则求出亚硫酸钠的质量偏大,即测定结果偏高,所以要在装置D后面加一个装有碱石灰的干燥管;
故答案为:偏高;在末端再增加一个装有碱石灰的干燥管.
故答案为:分液漏斗;
(2)浓硫酸具有吸水性,作干燥剂,用于干燥SO2气体,防止水蒸气和二氧化硫一起进入D,使二氧化硫的质量偏大;
故答案为:干燥SO2气体;
(3)装置D中干燥管实验前后增重的质量为二氧化硫的质量为4.8g,设亚硫酸钠为xg,
Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
126 64
xg 4.8g
x=
| 126×4.8g |
| 64 |
则质量分数为
| 9.45g |
| 10.0g |
(4)空气中的二氧化碳和水蒸气进入D会使二氧化硫的质量偏大,则求出亚硫酸钠的质量偏大,即测定结果偏高,所以要在装置D后面加一个装有碱石灰的干燥管;
故答案为:偏高;在末端再增加一个装有碱石灰的干燥管.
点评:本题考查了亚硫酸钠含量测定的实验,侧重于考查基本实验操作、有关方程式的计算、实验方案评价等,题目难度不大,侧重于考查学生的实验能力和计算能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
| A、0.04 |
| B、0.04mol/(L.s) |
| C、0.08mol(L.s) |
| D、0.04mol/L |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、18gH2O含有10 NA个质子 |
| B、1mol己烷含有18NA个化学键 |
| C、22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B、22.4L NH3中含有的原子总数为4NA |
| C、1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D、常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7 |
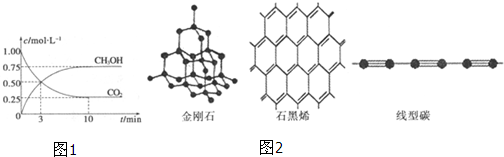
 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
| ||
| A、在前3分钟内v(H2)=10molL-1min-1 |
| B、在3分钟时CO2和CH3OH浓度相等,反应达到平衡 |
| C、在前15分钟内平衡常数K随CO2减少而逐渐减小 |
| D、在前15分钟时向设备中充入CO2和H2各10mol以提高H2转化率 |
 已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.
已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.