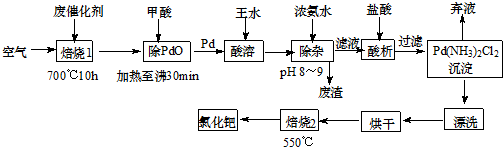
题目内容
X、Y、及W是短周期中的四种元素,其原子序数依次增大.相关信息如下表
(1)Z元素基态原子的核外电子排布式为 ,其未成对的电子数目为 .
(2)Y位于元素周期表中第 周期,第 族,四种元素的电负性由大到小的顺序是 (写元素符号).
(3)氢化物中X-H和W-H的化学键极性较强的是 ,耐磨材料(XY)和单质Y熔点较高的是 (均用元素符号表示).
(4)已知400℃时,HW 可被氧气催化氧化生成W的单质,从而实现化更生产上W的循环利用.若断开1mo1H-W化学键,该反应放热28.9kJ;试写出相应的热化学方程式: .
| 元素 | 相关信息 |
| X | 具有多种同素异形体,形成的化合物种类繁多 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 位于元素周期表金属与非金属元素的分界线上,最高化合价为+4 |
| W | 富集在海水中的元素,它的某些化合物常用作消毒刹 |
(2)Y位于元素周期表中第
(3)氢化物中X-H和W-H的化学键极性较强的是
(4)已知400℃时,HW 可被氧气催化氧化生成W的单质,从而实现化更生产上W的循环利用.若断开1mo1H-W化学键,该反应放热28.9kJ;试写出相应的热化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X具有多种同素异形体,形成的化合物种类繁多,故X是碳元素;
Y在短周期主族元素中,是原子半径最大的,故Y是钠元素;
Z位于元素周期表金属与非金属元素的分界线上,最高化合价为+4,属于短周期元素,故Z是硅元素;
W富集在海水中的元素,它的某些化合物常用作消毒刹,故W是氯元素,据此解答各小题即可.
Y在短周期主族元素中,是原子半径最大的,故Y是钠元素;
Z位于元素周期表金属与非金属元素的分界线上,最高化合价为+4,属于短周期元素,故Z是硅元素;
W富集在海水中的元素,它的某些化合物常用作消毒刹,故W是氯元素,据此解答各小题即可.
解答:
解:X具有多种同素异形体,形成的化合物种类繁多,故X是碳元素;
Y在短周期主族元素中,是原子半径最大的,故Y是钠元素;
Z位于元素周期表金属与非金属元素的分界线上,最高化合价为+4,属于短周期元素,故Z是硅元素;
W富集在海水中的元素,它的某些化合物常用作消毒刹,故W是氯元素,综上所述:X为碳,Y为钠,Z为硅,W为氯,
(1)Z是硅元素,Si有3个电子层,最外层有4个电子,故其核外电子排布式为:[Ne]3s23p2,其p层上2个电子未成对,故答案为:[Ne]3s23p2;2;
(2)钠处于第三周期第ⅠA族,X、Y、Z、W四种元素分别为C、Na、Si、Cl,电负性越大,即吸引电子能力越强,非金属性越强,因此电负性大小顺序为:Cl>C>Si>Na,故答案为:三;ⅠA;Cl>C>Si>Na;
(3)Cl元素电负性大,对电子吸引能力比C元素强,Cl-H键极性强于C-H,耐磨材料SiC为原子晶体,其熔点大于钠,故答案为:H-Cl;SiC;
(4)HCl可被氧气催化氧化生成氯气的单质,氧气与H原子结合生成水,由于温度是400℃,故此时水的状态为气体,依据元素守恒得出每生成1molCl2,需要断开2molH-Cl键,需要
molO2,故热化学反应方程式为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6kJ/mol,
故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6kJ/mol.
Y在短周期主族元素中,是原子半径最大的,故Y是钠元素;
Z位于元素周期表金属与非金属元素的分界线上,最高化合价为+4,属于短周期元素,故Z是硅元素;
W富集在海水中的元素,它的某些化合物常用作消毒刹,故W是氯元素,综上所述:X为碳,Y为钠,Z为硅,W为氯,
(1)Z是硅元素,Si有3个电子层,最外层有4个电子,故其核外电子排布式为:[Ne]3s23p2,其p层上2个电子未成对,故答案为:[Ne]3s23p2;2;
(2)钠处于第三周期第ⅠA族,X、Y、Z、W四种元素分别为C、Na、Si、Cl,电负性越大,即吸引电子能力越强,非金属性越强,因此电负性大小顺序为:Cl>C>Si>Na,故答案为:三;ⅠA;Cl>C>Si>Na;
(3)Cl元素电负性大,对电子吸引能力比C元素强,Cl-H键极性强于C-H,耐磨材料SiC为原子晶体,其熔点大于钠,故答案为:H-Cl;SiC;
(4)HCl可被氧气催化氧化生成氯气的单质,氧气与H原子结合生成水,由于温度是400℃,故此时水的状态为气体,依据元素守恒得出每生成1molCl2,需要断开2molH-Cl键,需要
| 1 |
| 2 |
故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6kJ/mol.
点评:本题主要考查的是元素的推断,以此为载体还考查了核外电子排布、元素电负性大小比较、热化学反应方程式书写等,有一定难度.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述中,正确的是( )
| A、标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA |
| B、7g CnH2n中含氢原子数为NA |
| C、78 g 过氧化钠与CO2反应,转移电子数为2NA |
| D、25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA |
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
| A、0.04 |
| B、0.04mol/(L.s) |
| C、0.08mol(L.s) |
| D、0.04mol/L |
某粒子的结构示意图为 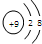 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )
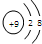 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )| A、核电荷数为9 |
| B、核外有两个电子层 |
| C、属于阴离子 |
| D、在化学反应中容易得到1个电子 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、18gH2O含有10 NA个质子 |
| B、1mol己烷含有18NA个化学键 |
| C、22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B、22.4L NH3中含有的原子总数为4NA |
| C、1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D、常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7 |
为测定石灰石样品中碳酸钙(含SiO2杂质)的含量.现利用如图所示装置进行实验,充分反应后,测定装置C中生成的BaCO3沉淀质量.下列说法正确的是( )


| A、装置A中药品应为浓硫酸 |
| B、在B-C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体 |
| C、为了测得C中生成的沉淀质量,需经过过滤、洗涤、干燥、称量等操作 |
| D、只要测定装置C在吸收CO2前后的质量差,也可以确定碳酸钙的质量分数 |