题目内容
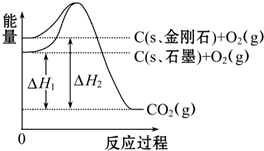
如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法或表示式正确的是( )

| A、C(s、石墨)═C(s、金刚石)△H=+1.9 kJ?mol-1 |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、1 mol石墨的能量比1 mol金刚石的总能量大 |
考点:反应热和焓变,物理变化与化学变化的区别与联系
专题:
分析:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.
解答:
解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ?mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ?mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、物质的能量越低越稳定,则石墨比金刚石稳定,金刚石能量大于石墨的总能量,故D错误;
故选:A.
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ?mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ?mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、物质的能量越低越稳定,则石墨比金刚石稳定,金刚石能量大于石墨的总能量,故D错误;
故选:A.
点评:本题考查热利用盖斯定律书写热化学方程式、物质的能量越低越稳定,题目难度不大,注意物质的稳定性与能量的关系.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列说法正确的是( )
| A、1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 |
| B、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
| C、油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 |
| D、欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等.甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐.下列说法正确的是( )
| A、原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B、甲沸点远高于乙,可能是甲分子间存在氢键所致 |
| C、测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D、W的氯化物水溶液中通入YX3至过量,现象是先有白色沉淀,后逐渐溶解 |
设NA为阿伏加德罗常数,下列叙述中,正确的是( )
| A、标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA |
| B、7g CnH2n中含氢原子数为NA |
| C、78 g 过氧化钠与CO2反应,转移电子数为2NA |
| D、25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA |
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
| A、0.04 |
| B、0.04mol/(L.s) |
| C、0.08mol(L.s) |
| D、0.04mol/L |