题目内容
10.下列叙述中,不正确的是( )| A. | 漂白粉的有效成分是氯化钠 | B. | 氯水中的次氯酸具有杀菌消毒作用 | ||
| C. | 过氧化钠可用作潜艇里氧气的来源 | D. | 食醋可用于清除暖水瓶中的水垢 |
分析 A.依据漂白粉中次氯酸钙的性质解答;
B.依据次氯酸的强氧化性解答;
C.过氧化钠与水、二氧化碳 反应都生成氧气;
D.依据水垢成分为碳酸钙、氢氧化镁及性质解答.
解答 解:A.漂白粉主要成分氯化钙、次氯酸钙,次氯酸钙具有强氧化性,能够杀菌,具有漂白作用,故A错误;
B.氯气与水反应生成的次氯酸具有强氧化性,能够使蛋白质变性,具有杀菌消毒作用,故B正确;
C.过氧化钠与水、二氧化碳 反应都生成氧气,所以过氧化钠可做供氧剂,故C正确;
D.水垢成分为碳酸钙、氢氧化镁,都能与醋酸反应生成可溶性盐,所以食醋可用于清除暖水瓶中的水垢,故D正确;
故选:A.
点评 本题考查了元素化合物知识,侧重考查物质的用途,熟悉相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
20.根据下列实验操作和现象所得出的结论不正确的是( )
| 实验操作 | 实验现象 | 结论 | |
| A | 向硅酸钠溶液中滴加1滴酚酞,再逐滴加入稀盐酸至红色褪去 | 试管里出现白色沉淀 | 酸性:盐酸>硅酸 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| C | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 向某无色溶液中先滴加氯水,再加少量CCl4,振荡,静置 | 溶液分层,下层为橙红色 | 溶液中含有Br- |
| A. | A | B. | B | C. | C | D. | D |
18. 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)SO2分子的空间构型为V形.
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
①写出NaClO2溶液脱硫过程中主要反应的离子方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O.增加压强,SO2的转化率提高(填“提高”“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐降低 (填“提高”“不变”或“降低”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
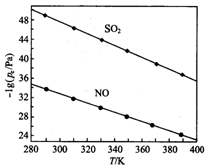
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压Pe如图所示.
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”“不变”或“减小”).
②反应ClO2-+2SO32-=2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{4}}^{2-})}$
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,降低硫酸根离子浓度,反应平衡向产物方向移动,SO2转化率提高.
 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:(1)SO2分子的空间构型为V形.
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐降低 (填“提高”“不变”或“降低”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压Pe如图所示.
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”“不变”或“减小”).
②反应ClO2-+2SO32-=2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{4}}^{2-})}$
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,降低硫酸根离子浓度,反应平衡向产物方向移动,SO2转化率提高.
5.下列物质可作为食品防腐剂的是( )
| A. | 甲醛 | B. | 硼酸 | C. | 苯甲酸钠 | D. | 醋酸 |
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1Na2S溶液与0.1 mol•L-1NaHS溶液等体积混合:2c(H2S)═3c(Na+)-2c(HS-)-2c(S2-) | |
| B. | 0.1 mol•L-1氨水与0.05 mol•L-1盐酸等体积混合:c(OH-)+c (NH3•H2O)═c(Cl-)+c(H+) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合:c(CH3COOH)+c(H+)>c(OH-)+c(Na+) | |
| D. | 浓度均为0.1 mol•L-1的NH4HSO4溶液与NaOH溶液等体积混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) |
2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )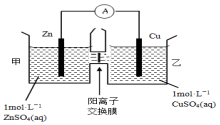

| A. | 铜电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
2.下列有关焰色反应的叙述正确的是( )
| A. | 只有金属的化合物灼烧时才会有不同的颜色 | |
| B. | 每次实验后,铂丝都要用水洗净 | |
| C. | 若透过蓝色钴玻璃只看到紫色,说明样品中含钾元素而一定不含钠元素 | |
| D. | 若样品灼烧呈黄色,判断一定有钠元素,但不能排除含其他金属元素 |
3.下列有关离子键和离子化合物的说法正确的是( )
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 在化合物MgCl2中,两个氯离子之间也存在离子键 | |
| C. | 离子化合物一定能导电 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |