题目内容
2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )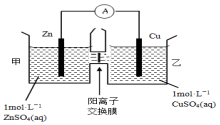
| A. | 铜电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大.
解答 解:A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A正确;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B正确;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,阴离子不能通过阳离子交换膜,故D错误,
故选:D.
点评 本题考查原电池工作原理,比较基础,注意阳离子交换膜不允许阳离子通过,C选项利用电荷守恒分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
12.下列实验能成功的是( )
| A. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 | |
| B. | 苯和浓溴水反应制溴苯 | |
| C. | CH3CH2Br中加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| D. | 将乙酸和乙醇混合加热制乙酸乙酯 |
10.下列叙述中,不正确的是( )
| A. | 漂白粉的有效成分是氯化钠 | B. | 氯水中的次氯酸具有杀菌消毒作用 | ||
| C. | 过氧化钠可用作潜艇里氧气的来源 | D. | 食醋可用于清除暖水瓶中的水垢 |
17.下列说法错误的是( )
| A. | 胶体粒子的大小在1nm~1000nm之间 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | 明矾在水中能生成氢氧化铝胶体,故可作净水剂 | |
| D. | 用光束照射CuSO4溶液不能观察到丁达尔效应 |
7.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为22.X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍.下列说法正确的是( )
| A. | 原子半径:W>R>Z | |
| B. | R的最高价氧化物的水化物酸性比W的强 | |
| C. | 气态氢化物的热稳定性:Y>W>R | |
| D. | W与X形成的是离子化合物 |
14.某同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 所用NaOH已经潮解 | |
| B. | 定容时观察液面俯视 | |
| C. | 洗涤烧杯和玻棒的溶液未转入容量瓶中 | |
| D. | 用带游砝的托盘天平称2.4 g NaOH时误用了“左码右物”方法 |
14.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和 Cl2反应的2-产物之一为 SO42-下列说法不正确的是( )
| A. | 该反应中的还原剂是 S2O32- | |
| B. | 根据该反应可判断氧化性:Cl2>SO42- | |
| C. | 上述反应中,每生成 1 mol SO42-,可脱去2molCl2 | |
| D. | 该反应的氧化产物是 Cl- |
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)<c(K+)═2c(Ba2+) | |
| D. | 常温下,0.2mol•L-1NH4NO3溶液与0.1mol•L-1NaOH溶液等体积混合,所得pH═9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |