题目内容
6. H2S、金属硫化物是硫的重要化合物.
H2S、金属硫化物是硫的重要化合物.(1)高温下,在恒容密闭容器中进行H2S分解实验,测得分解后得到H2和硫蒸汽,相同温度下气体压强之比为2:3(假设硫蒸汽成分只有1种),氧化产物的化学式为S2
(2)H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中回收硫,物质转化如图所示.
①图示中未参与氧化还原反应的离子是Cu2+、Cl-(填离子符号)
②若反应一段时间c(Fe3+)保持不变,则回收硫的总反应化学方程式是2CuS+4H++O2=2Cu2++2S+2H2O;
③用离子方程式表示Fe2+转化成Fe3+:4Fe2++O2+4H+=4Fe3++2H2O.在工业生产中,适当提高混合气体中空气含量,其目的是
(3)用氢氧化钠吸收H2S,用惰性材料作电极,电解硫化钠溶液,在阳极得到多硫化钠(Na2Sn),用稀硫酸与多硫化钠反应,得到Na2SO4、S和H2S.
分析 (1)气体压强之比等于气体物质的量之比,测得分解后得到H2和硫蒸汽,相同温度下气体压强之比为2:3;
(2)①根据图中各元素化合价变化分析;
②如图转化的关系分析可知,反应的化学方程式为CuS+2Fe3+=2Fe2++S+Cu2+,4Fe2++O2+4H+=4Fe3++2H2O,铁离子相当于做催化剂作用,所以回收硫的总反应化学方程式为:2CuS+4H++O2=2Cu2++2S+2H2O;
③Fe2+转化成Fe3+是氧气氧化亚铁离子为铁离子;
(3)Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S.
解答 解:(1)气体压强之比等于气体物质的量之比,测得分解后得到H2和硫蒸汽,相同温度下气体压强之比为2:3,则依据物质的量之比和原子守恒写出化学方程式为:2H2S$\frac{\underline{\;\;△\;\;}}{\;}$2H2+S2,氧化产物为S2,
故答案为:S2;
(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,离子为
故答案为:Cu2+、Cl-;
②根据氧化还原反应中得失电子相等得,反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,消耗O2的物质的量=$\frac{1}{2}$mol=0.5mol,如图转化的关系分析可知,反应的化学方程式为CuS+2Fe3+=2Fe2++S+Cu2+,4Fe2++O2+4H+=4Fe3++2H2O,铁离子相当于做催化剂作用,所以回收硫的总反应化学方程式为:2CuS+4H++O2=2Cu2++2S+2H2O,
故答案为:2CuS+4H++O2=2Cu2++2S+2H2O;
③Fe2+转化成Fe3+的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,在工业生产中,适当提高混合气体中空气含量,其目的是增大氧气的量使硫元素全部生成单质硫,保持铁离子浓度不变,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O,增大氧气的量使硫元素全部生成单质硫;
(3)电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,
故答案为:H2S.
点评 本题考查了氧化还原反应的分析判断,离子性质和元素化合价变化分析应用,掌握题干信息是解题关键,题目难度中等.

| A. | 过氧化钠的电子式: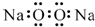 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: | D. | NH4Cl的电子式: |
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

(1)分别写出反应①、③、④的离子方程式:①Cr2O72-+3Zn+14H+=2Cr3++3Zn2++7H2O、③Cr(OH)3+OH-=CrO2-+2H2O、④2CrO2-+3H2O2+2OH-=2CrO42-+4H2O
(2)结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液.
(3)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(4)将KCl和CrCl3两种固体混合物共熔制得化合物X.将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O.另取0.0035mol X溶于水中,当加入0.0385mol Ag NO3时,恰好沉淀完全.则表示X组成的化学式为K5Cr2Cl11.
| A. | 苯制备硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入热的氧化铜中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
| A. | 密度大小:硝基苯>水>苯 | |
| B. | 熔、沸点高低:乙醇>丁烷>丙烷 | |
| C. | 含碳量大小:乙烷>乙醇>乙酸 | |
| D. | 等质量燃烧时的耗氧量:乙烷>乙烯>丙烯 |
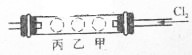 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是: