题目内容
18.已知室温时AgBr的溶解度是8.8×10-7mo1/L,MgNH4PO4溶解度是6.3×10-5mol/L,求AgBr、MgNH4PO4的溶度积.分析 AgBr(s)?Ag++Br-、MgNH4PO4(s)?Mg2++NH4++PO43-、根据溶度积的计算公式计算即可.
解答 解:AgBr(s)?Ag++Br-
因为溶解的AgBr可认为完全电离
所以c(Ag+)=c(Br-)=8.8×10-7 mol•L-1
Ksp(AgBr)=c(Ag+)•c(Br-)=(8.8×10-7)2=7.7×10-13
同理MgNH4PO4(s)?Mg2++NH4++PO43-
因为溶解的Mg(NH4)PO4可认为完全电离,
所以c(Mg2+)=c(NH4+)=c(PO43-)=6.3×10-5 mol•L-1
所以Ksp(MgNH4PO4)=c(Mg2+)c(NH4+)c(PO43-)=(6.3×10-5)3=2.5×10-13
答:AgBr的溶度积为7.7×10-13,MgNH4PO4的溶度积为2.5×10-13.
点评 本题考查溶度积与溶解度的计算,注意溶解平衡方程式的书写,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
8.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法正确的是( )
反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法正确的是( )
| A. | 降低温度,H2S浓度减小,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为10 mol | |
| D. | H2S的平衡转化率为28.6% |
10.2008年9月27日,中国航天员首次在太空成功回收了暴露试验的固体润滑材料,这些搭载“神七”飞船的材料共分为4大类15种,这是中国首次暴露于太空环境并成功回收的空间材料试验样品,经过太空的试验以后,以肉眼观察,发现两类产品变化很大,一类是银与银合金的薄膜材料,经过原子氧和紫外光的辐照以后,其表面变花或者变暗;另一类是二硫化钼润滑薄膜产品,表面变得更为粗糙.下列有关说法正确的是( )
| A. | 原子氧比氧气化学性质活泼,二者互为同素异形体 | |
| B. | 银与银合金的薄膜材料化学性质活泼 | |
| C. | 原子氧和紫外光的辐照对二硫化钼润滑薄膜产品没有影响 | |
| D. | 二硫化钼润滑薄膜产品不适合用作航天器的润滑剂 |
7.恒温恒压下,一个容积可变的密闭容器中发生反应:A(g)+B(g)═C(g).若开始时通入1molA和1molB,则达到平衡时生成a molC.则下列说法错误的是( )
| A. | 若开始时通入3molA和3molB,则达到平衡时,生成C的物质的量为3amol | |
| B. | 若开始时通入4molA和4molB、2molC,则达到平衡时,生成B的物质的量一定大于4mol | |
| C. | 若开始时通入2molA和2molB、1molC,则达到平衡时,在通入3molC,则再次达到平衡后,C的体积分数为$\frac{a}{2-a}$ | |
| D. | 若在原平衡体系中,在通入1molA和1molB,则混合气体的平均相对分子质量不变 |
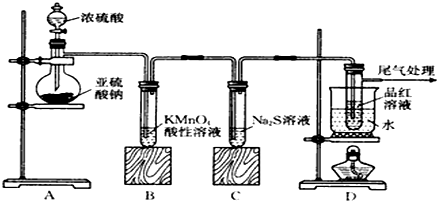
 H2S、金属硫化物是硫的重要化合物.
H2S、金属硫化物是硫的重要化合物.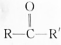 结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.
结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.