题目内容
室温下,对于0.10mol?L-1的氨水,下列判断正确的是( )
| A、用相同浓度的HNO3溶液中和,硝酸体积小于氨水时,溶液可能呈中性 |
| B、温度不变,加水稀释后溶液中c(NH4+)?c(OH-)不变 |
| C、加水稀释后,溶液中导电粒子的数目减少 |
| D、其溶液的pH=13 |
考点:弱电解质在水溶液中的电离平衡,水的电离
专题:电离平衡与溶液的pH专题
分析:A.硝酸铵溶液呈酸性,要使溶液呈中性,氨水稍微过量;
B.加水稀释促进一水合氨电离,溶液中c(NH4+)、c(OH-)都减小;
C.加水稀释后,溶液中c(H+)增大;
D.一水合氨为弱电解质,在水溶液里部分电离.
B.加水稀释促进一水合氨电离,溶液中c(NH4+)、c(OH-)都减小;
C.加水稀释后,溶液中c(H+)增大;
D.一水合氨为弱电解质,在水溶液里部分电离.
解答:
解:A.硝酸铵溶液呈酸性,要使溶液呈中性,氨水稍微过量,二者浓度相等,所以硝酸体积小于氨水时,溶液可能呈中性,故A正确;
B.加水稀释促进一水合氨电离,溶液中c(NH4+)、c(OH-)都减小,则c(NH4+)?c(OH-)减小,故B错误;
C.加水稀释后,溶液中c(NH4+)、c(OH-)减小,温度不变,离子积常数不变,则c(H+)增大,故C错误;
D.一水合氨为弱电解质,在水溶液里部分电离,则该溶液中c(OH-)小于0.1mol/L,则溶液的pH<13,故D错误;
故选A.
B.加水稀释促进一水合氨电离,溶液中c(NH4+)、c(OH-)都减小,则c(NH4+)?c(OH-)减小,故B错误;
C.加水稀释后,溶液中c(NH4+)、c(OH-)减小,温度不变,离子积常数不变,则c(H+)增大,故C错误;
D.一水合氨为弱电解质,在水溶液里部分电离,则该溶液中c(OH-)小于0.1mol/L,则溶液的pH<13,故D错误;
故选A.
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,加水稀释时,氨水中c(H+)增大,但离子积常数不变,题目难度不大.

练习册系列答案
相关题目
根据如图实验装置判断,下列说法正确的是( )


| A、该装置能将电能转化为化学能 |
| B、活性炭为正极,其电极反应式为:2H++2e-═H2↑ |
| C、电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D、装置内总反应方程式为:4Al+3O2+6H2O═4Al(OH)3 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>KAl(OH)3;则下列相关离子方程式正确的是( )
| A、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ |
| B、小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
| C、“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O═CO32-+2HClO |
| D、在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O═2Fe3++Cl-+2OH- |
25℃时,将0.2mol KF固体溶于100mL 1mol?L-1 HBr溶液中,加水稀释得到1L溶液,若此溶液中c(F-)>c(Br-),下列判断不正确的是( )
| A、该溶液的pH小于7 |
| B、c(HF)+c(F-)=0.2 mol?L-1 |
| C、c(HF)<c(F-) |
| D、c(F-)+c(OH-)=0.1 mol?L-1 |
如图实验装置或操作能达到目的是( )
A、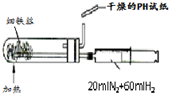 合成氨并检验氨的生成 |
B、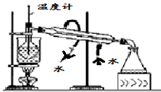 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| A、MgSO4,CuSO4 |
| B、AgNO3,Pb(NO3)2 |
| C、FeSO4,Al2 (SO4)3 |
| D、CuSO4,AgNO3 |

 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: