题目内容
取一定量的Fe、Cu的混合物粉末,每次向其中加入100ml稀硝酸,实验中收集到的NO气体(惟一还原产物)的总体积及所得剩余物的质量记录如下(所有体积均在标准状况下测定):
(1)该实验中所用稀硝酸的物质的量浓度为 .
(2)第4次实验中产生气体的原因(用离子方程式表示)
(3)第1次实验后剩余固体为 ,第2次实验后剩余固体为 .(均填写化学式)
(4)混合物中铜的质量为 .
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液总体积 | 100mL | 200mL | 300mL | 400mL | 500mL |
| 剩余固体的质量 | 18.6g | 9.6g | 0g | 0g | 0g |
| 气体体积 | 2.24L | 4.48L | 6.72L | 8.4L | 8.4L |
(2)第4次实验中产生气体的原因(用离子方程式表示)
(3)第1次实验后剩余固体为
(4)混合物中铜的质量为
考点:有关混合物反应的计算
专题:计算题
分析:(1)实验1中金属有剩余,则硝酸完全反应,发生反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,根据生成NO的体积,结合方程式计算n(HNO3),进而计算c(HNO3);
(2)实验3中没有金属剩余,实验4中又生成NO,为硝酸与亚铁离子反应生成NO;
(3)由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体,转移0.15 mol电子,若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以第1次实验后剩余金属为Fe和Cu,第2次实验后剩余金属只有Cu;
(4)假设在实验1的基础上再加入100mL硝酸溶液溶解的9.2g金属中Fe、Cu物质的量分别为xmol、ymol,根据二者质量及转移电子守恒列方程计算,混合物中Cu的质量为剩余金属(Cu)的质量与反应Cu的质量之和.
(2)实验3中没有金属剩余,实验4中又生成NO,为硝酸与亚铁离子反应生成NO;
(3)由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体,转移0.15 mol电子,若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以第1次实验后剩余金属为Fe和Cu,第2次实验后剩余金属只有Cu;
(4)假设在实验1的基础上再加入100mL硝酸溶液溶解的9.2g金属中Fe、Cu物质的量分别为xmol、ymol,根据二者质量及转移电子守恒列方程计算,混合物中Cu的质量为剩余金属(Cu)的质量与反应Cu的质量之和.
解答:
解:(1)实验1中金属有剩余,则硝酸完全反应,发生反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
n(NO)=
=0.1mol,由方程式可知n(HNO3)=0.1mol×
=0.4mol,故c(HNO3)=
=4mol/L,
故答案为:4mol/L;
(2)实验3中没有金属剩余,实验4中又生成NO,为硝酸与亚铁离子反应生成NO,反应离子方程式为:4H++NO3-+3Fe2+═3Fe3++NO↑+2H2O,
故答案为:4H++NO3-+3Fe2+═3Fe3++NO↑+2H2O;
(3)由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体,转移0.15 mol电子,若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以第1次实验后剩余金属为Fe和Cu,第2次实验后剩余金属只有Cu,
故答案为:Fe、Cu;Cu;
(4)假设在实验1的基础上再加入100mL硝酸溶液溶解的9.2g金属中Fe、Cu物质的量分别为xmol、ymol,则:
由质量可得:56 x+64 y=9.2
根据电子转移守恒可得:2(x+y)=3×0.1
解得:x=0.05 y=0.1,
故混合物中Cu的质量为:0.1mol×64g/mol+6.4 g,
每次所取混合物中铜的质量6.4 g+9.6 g=16 g,
故答案为 16 g.
n(NO)=
| 2.24L |
| 22.4L/mol |
| 8 |
| 2 |
| 0.4mol |
| 0.1L |
故答案为:4mol/L;
(2)实验3中没有金属剩余,实验4中又生成NO,为硝酸与亚铁离子反应生成NO,反应离子方程式为:4H++NO3-+3Fe2+═3Fe3++NO↑+2H2O,
故答案为:4H++NO3-+3Fe2+═3Fe3++NO↑+2H2O;
(3)由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体,转移0.15 mol电子,若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以第1次实验后剩余金属为Fe和Cu,第2次实验后剩余金属只有Cu,
故答案为:Fe、Cu;Cu;
(4)假设在实验1的基础上再加入100mL硝酸溶液溶解的9.2g金属中Fe、Cu物质的量分别为xmol、ymol,则:
由质量可得:56 x+64 y=9.2
根据电子转移守恒可得:2(x+y)=3×0.1
解得:x=0.05 y=0.1,
故混合物中Cu的质量为:0.1mol×64g/mol+6.4 g,
每次所取混合物中铜的质量6.4 g+9.6 g=16 g,
故答案为 16 g.
点评:本题考查混合物计算、硝酸性质,明确发生的反应判断反应进行程度是解题关键,(3)中注意利用极限法进行解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
为了提高SO2的转化率,通常通入过量的空气,使SO2充分和O2反应,则从接触室导出的混合气体含有( )
| A、SO3、O2 |
| B、SO3、O2、N2 |
| C、SO3、SO2、O2、N2 |
| D、SO3、N2 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A、未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B、因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C、铁制品应该连接在直流电源的负极 |
| D、镀锌层破损后即对铁制品失去保护作用 |
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
则下列分析推理中不正确的是( )
| Ⅰ | Ⅱ | Ⅲ | |
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 13.8g | 14.2g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、根据表中第Ⅱ组数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、盐酸的物质的量浓度为3.0mol?L-1 |
| D、13.8g混合物恰好与盐酸完全反应 |
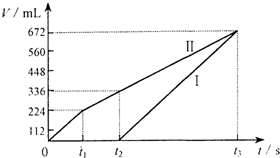 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测: 含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol?L-1NaOH之后,改成滴加C2mol?L-1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示.据此,回答下列问题:
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol?L-1NaOH之后,改成滴加C2mol?L-1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示.据此,回答下列问题: