题目内容
3.某实验小组在老师的带领下测量一块大理石CaCO3的质量分数,取30g大理石样品放在大试管中,加入500mL稀盐酸,恰好完全反应,产生2.24L气体(标准状况下).求:(1)大理石中CaCO3的质量分数;
(2)稀盐酸的物质的量浓度.
分析 本题可直接利用2.24L气体(标准状况下)即二氧化碳的量,借助化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑来进行相关的计算.
解答 解:设样品中含碳酸钙的质量为x,盐酸溶液中含HCl的物质的量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 2 22.4L
x y 2.24L
$\frac{100}{x}$=$\frac{2}{y}$=$\frac{22.4}{2.24}$
x=10g,y=0.2mol
则(1)样品中CaCO3的质量分数为$\frac{10g}{30g}$×100%═33.3%;
(2)稀盐酸的物质的量浓度为:$\frac{0.2mol}{0.5L}$=0.4mol/L;
答:(1)样品中 CaCO3的质量分数为33.3%;
(2)稀盐酸的物质的量浓度为0.4mol/L.
点评 本题较简单,可直接利用化学方程式来计算,但应注意计算格式要规范,向规范要质量.

练习册系列答案
相关题目
13.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景.
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
| A. | 2FeCO3(s)+$\frac{1}{2}$O2 (g)=Fe2O3(s)+2CO2(g)△H=+130 KJ/mol | |
| B. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol |
14.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
| A. | 1:1:l | B. | 2:2:1 | C. | 1:1:2 | D. | 4:3:2 |
18. 请按要求回答下列有关氮的化合物参与相关反应的问题:
请按要求回答下列有关氮的化合物参与相关反应的问题:
Ⅰ、工业上常用NH4Cl溶液将有毒的NaNO2废液进行无害处理,写出该反应的离子方程式:NH4++NO2-=N2↑+2H2O.
Ⅱ、已知汽车尾气净化原理之一:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;
(1)判断该反应能自发进行的条件是低温.
(2)一定温度下,若在体积为2L的密闭容器中发生该化学反应,0~4min各物质的物质的量的变化(部分数据)如表所示:
①0~2min内用NO来表示的平均反应速率v(NO)=0.2mol/(L.min).
②此温度下该反应的化学平衡常数的值K=80;
平衡时CO的转化率α(CO)=80%.
(3)在恒温恒压条件下,下列叙述可确定该反应已达平衡的是CD.
A.消耗v(CO)等于消耗v(NO) B.N2与CO2的物质的量之比为1:1时
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
(4)若一定温度下,将一定量的NO、CO充入容积可变的密闭容器中,该反应达到平衡状态时容积为3L,c(N2)随时间t的变化曲线如图所示.
①在t2min时改变的条件是快速将容器的体积由3L压到2L.
②若将容器保持3L恒定,在t2min时升高温度,t3min时该反应重新达到平衡,请在上图中画出在t2~t4内c(N2)的变化曲线.
 请按要求回答下列有关氮的化合物参与相关反应的问题:
请按要求回答下列有关氮的化合物参与相关反应的问题:Ⅰ、工业上常用NH4Cl溶液将有毒的NaNO2废液进行无害处理,写出该反应的离子方程式:NH4++NO2-=N2↑+2H2O.
Ⅱ、已知汽车尾气净化原理之一:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;
(1)判断该反应能自发进行的条件是低温.
(2)一定温度下,若在体积为2L的密闭容器中发生该化学反应,0~4min各物质的物质的量的变化(部分数据)如表所示:
| n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol | |
| 起始 | 1.2 | 1.0 | 0 | 0 |
| 2min末 | 0.4 | |||
| 4min末 | 0.8 |
②此温度下该反应的化学平衡常数的值K=80;
平衡时CO的转化率α(CO)=80%.
(3)在恒温恒压条件下,下列叙述可确定该反应已达平衡的是CD.
A.消耗v(CO)等于消耗v(NO) B.N2与CO2的物质的量之比为1:1时
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
(4)若一定温度下,将一定量的NO、CO充入容积可变的密闭容器中,该反应达到平衡状态时容积为3L,c(N2)随时间t的变化曲线如图所示.
①在t2min时改变的条件是快速将容器的体积由3L压到2L.
②若将容器保持3L恒定,在t2min时升高温度,t3min时该反应重新达到平衡,请在上图中画出在t2~t4内c(N2)的变化曲线.
8.标准状况下,下列关于气体的说法中正确的是( )
| A. | 2mol氧气与1mol二氧化硫的质量比约为2:1 | |
| B. | 2mol氧气与1mol二氧化硫的体积比约为1:1 | |
| C. | 1mol氧气与3mol二氧化硫的体积比约为1:3 | |
| D. | 1mol氧气与3mol二氧化硫的密度比约为1:3 |
1.下列物质的分类合理的是( )
| A. | 酸性氧化物:CO2、SO2、H2O | B. | 碱性氧化物:Na2O、CaO、P2O5 | ||
| C. | 碱:NaOH、KOH、Ba(OH)2 | D. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4 |
2.短周期元素的性质或原子结构如表:
(1)写出元素X的离子结构示意图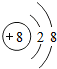 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式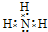 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示).
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
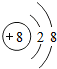 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式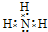 (用元素符号表示)
(用元素符号表示)(2)写出Y元素最高价氧化物水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示).
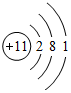 ,B离子的电子式
,B离子的电子式 ,C原子的名称氢原子,D原子的电子式
,C原子的名称氢原子,D原子的电子式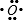 .
.