题目内容
14.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 常温常压下,8 g O2含有5NA个电子 | |
| B. | 1 L 1.0 mol•L-1NaAlO2溶液中含有氧原子数为2NA | |
| C. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| D. | 精炼铜的过程中,当阴极析出32 g铜时转移的电子数为NA |
分析 A、求出氧气的物质的量,然后根据1mol氧气中含16mol电子来分析;
B、在偏铝酸钠溶液中,除了偏铝酸钠本身,水中也含氧原子;
C、标况下四氯化碳为液体;
D、阴极上的电极反应为:Cu2++2e-=Cu.
解答 解:A、8g氧气的物质的量为0.25mol,而1mol氧气中含16mol电子,故0.25mol氧气中含4mol电子即4NA个,故A错误;
B、在偏铝酸钠溶液中,除了偏铝酸钠本身,水中也含氧原子,故溶液中的氧原子的个数大于2NA个,故B错误;
C、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、阴极上的电极反应为:Cu2++2e-=Cu,故当阴极上析出32g铜即0.5mol铜时,转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.在恒容密闭容器中发生反应2NO2?2NO+O2,下列所述可以说明反应达到平衡状态的是( )
| A. | 单位时间内生成n molO2的同时生成2n molNO | |
| B. | 混合气体的平均相对分子质量不再改变 | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的密度不再改变 |
2.标准状况下,现有①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,对这四种气体的关系有以下四种表述:
a.体积:②>③>①>④
b.物质的量:②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
其中正确的是( )
a.体积:②>③>①>④
b.物质的量:②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
其中正确的是( )
| A. | abc | B. | bcd | C. | abcd | D. | acd |
19.金属钠分别与下列物质的溶液反应时,既有气体放出又有白色沉淀生成的是( )
| A. | 盐酸 | B. | 氯化钠 | C. | 氯化铜 | D. | 氯化镁 |
6.下列物质种类中,前者包含后者的是( )
| A. | 混合物 溶液 | B. | 电解质 化合物 | C. | 浊液 胶体 | D. | 单质 化合物 |
3.不能使湿润的淀粉碘化钾试纸变蓝的物质是( )
| A. | 溴水 | B. | 碘酒 | C. | 氯化钠 | D. | 氯气 |
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.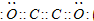 .
.