题目内容
4. 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.请回答下列问题(填空时用实际符号):
(1)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为
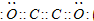 .
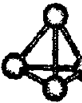
.(2)最近意大利罗马大学的FuNvioCacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示,已知断裂l molC-C吸收167kJ热量,生成l mol C≡C放出942kJ热量.根据以上信息和数据,下列说法正确的是①.
A.C4与C2互为同素异形体 B.C4与C2互为同分异构体
C.C4属于一种新型的化合物 D.1mol C4气体转变为C2放出882kJ热量
(3)C与F两种元素形成一种化合物分子,各原子最外层未都达8电子结构,则该分子的分子式为NCl3.
(4)为了除去化合物乙(A2ED4)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:H2O2+H2SO3=2H++SO42-+H2O.
(5)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似.对此以下说法正确的是abc.
a.E2F2的结构式为:F-E-E-F
b.E2F2为含有极性键和非极性键的分子
c.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O═EO2+3E↓+4HF
(6)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):C12+H2S=S↓+2HCl.
分析 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型,为3原子分子,D、E为-2价,故D为O元素,E为S元素;F原子序数大于硫元素,故F为Cl元素;A分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态,则A为H元素;A、B的最外层电子数之和与C的最外层电子数相等,则B为碳元素、C为N元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型,为3原子分子,D、E为-2价,故D为O元素,E为S元素;F原子序数大于硫元素,故F为Cl元素;A分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态,则A为H元素;A、B的最外层电子数之和与C的最外层电子数相等,则B为碳元素、C为N元素.
(1)B为碳元素,D为氧元素,直线型气态化合物 B2D2分子为C2O2,且各原子最外层都满足8电子结构,分子中碳原子与碳原子之间形成2对共用电子对,每个碳原子与1个氧原子形成2对共用电子对,则C2O2电子式为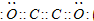 ,
,
故答案为: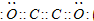 ;
;
(2)①N4与N2都是氮元素组成的结构不同的单质,互为同素异形体,故①错误;
②同分异构体研究对象为化合物,N4与N2互为同素异形体,故②错误;
③N4只含一种元素,属于单质,故③错误;
④lmol N4气体转变为N2,断开化学键吸收能量为167kJ×4=668kJ,形成化学键放出能量为942kJ×2=1884kJ,所以反应放出能量为1884kJ-668kJ=1276kJ,故④错误;
故选:①;
(3)C为氮元素,F为氯元素,两种元素形成一种化合物分子,各原子最外层达8电子结构,分子中存在3个N-Cl键,则该分子化学式为NCl3,
故答案为:NCl3;
(4)A2ED3为H2SO3,A2D2是H2O2,H2O2将亚硫酸氧化为硫酸,反应离子方程式为H2O2+H2SO3=2H++SO42-+H2O,
故答案为:H2O2+H2SO3=2H++SO42-+H2O;
(5)E与F形成的化合物E2F2为S2Cl2,遇水易水解,其空间结构与H2O2极为相似.
a.S2Cl2的空间结构与H2O2极为相似,所以结构式为:Cl-S-S-Cl,故a正确;
b.H2O2为打开的书页形结构,-O-H处于两个平面,是极性分子,S2Cl2的空间结构与H2O2极为相似,为含有极性键和非极性键的极性分子,故b正确;
c.S2Cl2遇水解,反应2S2Cl2+2H2O=SO2↑+3S↓+4HF,符合氧化还原反应,且电子转移相等,可能发生该反应,故c正确,
故选:abc;
(6)元素的非金属性越强,单质的氧化性越强,氧化剂氧化性强于氧化产物氧化性,所以反应:C12+H2S=S↓+2HCl,可以说明Cl的非金属性比S强.
故答案为:C12+H2S=S↓+2HCl.
点评 考查结构性质与位置关系、化学用语、晶体结构\元素化合物性质、氧化还原反应等,难度较大,是对学生综合能力的考查,注意基础知识的全面掌握.

| A. | 常温常压下,8 g O2含有5NA个电子 | |
| B. | 1 L 1.0 mol•L-1NaAlO2溶液中含有氧原子数为2NA | |
| C. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| D. | 精炼铜的过程中,当阴极析出32 g铜时转移的电子数为NA |
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)Z元素在周期表中的位置是第三周期第ⅦA族;Y的一种氧化物能导致温室效应,该氧化物的电子式火
 ;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.
;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是HClO4>HNO3>H2CO3.
(3)实验室制取Z单质的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)实验室制取X的氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;工业上用此氢化物制取X的最高价含氧酸的第一步反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)实验室用X的氢化物的水溶液制取W的氢氧化物的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
| A. | NO2只起还原剂作用 | B. | NO2起催化剂作用 | ||
| C. | NO2只起氧化剂作用 | D. | O3与O2互为同分异构体 |
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将减小.(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1 000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-═2N2O5+2H+.
| A | B | C | D | |
| 实验 | 用酒精提取溴水中的Br2 | 除去氢氧化铁胶体中的铁离子 | 分离NH4Cl和I2的固体混合物 | 稀释10mL98% 的浓硫酸溶液 |
| 装置或仪器 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | 42He原子核内含有2个质子 | |
| B. | 32He和42He互为同素异形体 | |
| C. | 32He原子核内含有2个中子 | |
| D. | 42He的最外层电子数为4,所以42He具有较强的金属性 |
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.