题目内容
 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.(1)CH3COOH的中和热△H=
(2)在做中和反应的反应热的测定实验时,下列操作错误的是
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应进行更完全,可以是酸(碱)适当过量
E.若用KOH代替NaOH,对测定结果有影响.
(3)你认为CH3COOH的中和热与HCl的中和热数值相比,
考点:中和热的测定
专题:实验题
分析:(1)先根据溶液反应放出的热量Q=-cm△T+150.5J?0C-1×△T,再根据中和热△H=-
计算即可;
(2)A.反应前酸、碱溶液的温度要相同;
B.为观察溶液温度的变化,温度计要一直插在溶液中;
C.向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小;
D.为了使反应进行更完全,酸或碱要过量;
E.KOH代替NaOH都是强碱,符合中和热的概念;
(3)醋酸是弱酸,电离过程需要吸收能量.
| Q |
| n(H2O) |
(2)A.反应前酸、碱溶液的温度要相同;
B.为观察溶液温度的变化,温度计要一直插在溶液中;
C.向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小;
D.为了使反应进行更完全,酸或碱要过量;
E.KOH代替NaOH都是强碱,符合中和热的概念;
(3)醋酸是弱酸,电离过程需要吸收能量.
解答:
解:(1)温度差△t=300.7K-298.0K=2.7K,Q=cm△t=2.7K×4.184J?(g?K)-1×200g+150.5J?K-1×2.7K=2665.71J=2.67kJ,△H=
=-
=-53.3 kJ/mol;
故答案为:-53.3 kJ/mol;
(2)A.为减少误差,反应前酸、碱溶液的温度要相同,故A不选;
B.为观察溶液温度的变化,测量溶液的温度计要一直插在溶液中,故B不选;
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小,故C选;
D.为了使反应进行更完全,可以是酸(碱)适当过量,故D不选;
E.用KOH代替NaOH,KOH也是强碱,符合中和热的概念,对测定结果无影响,故E选;
故答案为:CE;
(3)CH3COOH是弱酸,电离过程需要吸收能量,所以CH3COOH的中和热与HCl的中和热数值相比,HCl较大;
故答案为:HCl;CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少.
| -Q |
| n(H2O) |
| 2.67kJ |
| 0.05mol |
故答案为:-53.3 kJ/mol;
(2)A.为减少误差,反应前酸、碱溶液的温度要相同,故A不选;
B.为观察溶液温度的变化,测量溶液的温度计要一直插在溶液中,故B不选;
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小,故C选;
D.为了使反应进行更完全,可以是酸(碱)适当过量,故D不选;
E.用KOH代替NaOH,KOH也是强碱,符合中和热的概念,对测定结果无影响,故E选;
故答案为:CE;
(3)CH3COOH是弱酸,电离过程需要吸收能量,所以CH3COOH的中和热与HCl的中和热数值相比,HCl较大;
故答案为:HCl;CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少.
点评:本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列离子方程式不正确的是( )
| A、向Ba(OH)2溶液中滴加NH4HSO4溶液刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| B、向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、在NaOH溶液中通入少量的SO2气体:SO2+OH-=HSO3- |
| D、二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
 短周期元素X、Y、Z的位置如图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍.X、Y、Z三元素的元素符号是( )
短周期元素X、Y、Z的位置如图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍.X、Y、Z三元素的元素符号是( )| A、N、Si、S |
| B、O、P、C1 |
| C、F、S、Ar |
| D、C、A1、P |
下列图示的实验能达到实验目的是( )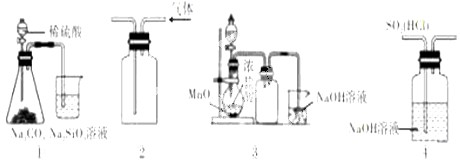

| A、图①实验装置可验证非金属性:S>C>Si |
| B、图②实验装置收集NO2气体 |
| C、图③实验装置可制备、收集Cl2 |
| D、图③实验装置可去除SO2中HCl |
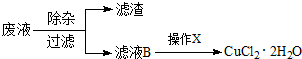
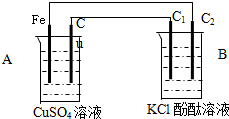 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题: