题目内容
废旧印刷线路板处理时常用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜.
(1)用FeCl3溶液溶解印刷线路板上金属铜的离子方程式为 .
(2)工业上也可用腐蚀废液制备CuCl2?2H2O,从而进行对废液的利用,其工艺流程如下: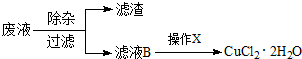
①除杂时先通入足量Cl2将Fe2+氧化成Fe3+,再加CuO固体调节溶液的pH在3.2~4.7.将Fe2+氧化成Fe3+目的是 .调控溶液pH时采用pH试纸来测定溶液的pH,则正确的操作方法 .
②操作X包括蒸发浓缩、冷却结晶、过滤和洗涤等,不能用热水洗涤的原因是 .
③测定产品中CuCl2?2H2O的质量分数如下:取2.000g产品,用水溶解后,加入60.00mL 0.4000mol?L-1的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000mol?L-1 Na2S2O3标准溶液滴定,耗去此标准液25.00mL时,刚好到达滴定终点.此产品中CuCl2?2H2O的质量分数为 ,配制250.00mL 0.4000mol?L-1的KI溶液用到的玻璃仪器主要有烧杯、玻璃棒、 .(已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-).
(1)用FeCl3溶液溶解印刷线路板上金属铜的离子方程式为
(2)工业上也可用腐蚀废液制备CuCl2?2H2O,从而进行对废液的利用,其工艺流程如下:

①除杂时先通入足量Cl2将Fe2+氧化成Fe3+,再加CuO固体调节溶液的pH在3.2~4.7.将Fe2+氧化成Fe3+目的是
②操作X包括蒸发浓缩、冷却结晶、过滤和洗涤等,不能用热水洗涤的原因是
③测定产品中CuCl2?2H2O的质量分数如下:取2.000g产品,用水溶解后,加入60.00mL 0.4000mol?L-1的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000mol?L-1 Na2S2O3标准溶液滴定,耗去此标准液25.00mL时,刚好到达滴定终点.此产品中CuCl2?2H2O的质量分数为
考点:铁盐和亚铁盐的相互转变,化学方程式的有关计算
专题:计算题,元素及其化合物
分析:(1)铜与氯化铁反应生成氯化铜、氯化亚铁;
(2)①先将Fe2+转化成Fe3+,三价铁离子沉淀完全后,进行过滤即可,根据pH试纸的使用方法来回答;
②Cu2+发生水解的过程是吸热的过程;
③根据反应的过程:2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,得到关系式:Cu2+~S2O32-,进行计算即可.
(2)①先将Fe2+转化成Fe3+,三价铁离子沉淀完全后,进行过滤即可,根据pH试纸的使用方法来回答;
②Cu2+发生水解的过程是吸热的过程;
③根据反应的过程:2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,得到关系式:Cu2+~S2O32-,进行计算即可.
解答:
解:(1)铁离子具有氧化性,Cu有还原性,二者反应的实质是:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)①首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在pH值3.2~4.7时三价铁离子完全沉淀,然后通过过滤除去生成的沉淀;用pH试纸测pH的方法:将一小块pH试纸置于干燥洁净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,跟标准比色卡对照,故答案为:便于除去铁元素;将一小块pH试纸置于干燥洁净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,跟标准比色卡对照;
②为了防止Cu2+发生水解、减少CuCl2?2H2O 的溶解,提高产率,不能用热水洗涤CuCl2?2H2O,故答案为:防止Cu2+发生水解、减少CuCl2?2H2O 的溶解,提高产率;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 Na2S2O3 ~Cu2+
1 1
0.4000mol/L×0.0250L 0.01mol
则CuCl2?2H2O的物质的量为:0.01mol,
试样中CuCl2?2H2O的质量百分数为
×100%=85.50%,配制250.00mL 0.4000mol?L-1的KI溶液用到的玻璃仪器主要有烧杯、玻璃棒、250mL的容量瓶、胶头滴管,故答案为:85.50%;250mL的容量瓶、胶头滴管.
(2)①首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在pH值3.2~4.7时三价铁离子完全沉淀,然后通过过滤除去生成的沉淀;用pH试纸测pH的方法:将一小块pH试纸置于干燥洁净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,跟标准比色卡对照,故答案为:便于除去铁元素;将一小块pH试纸置于干燥洁净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,跟标准比色卡对照;
②为了防止Cu2+发生水解、减少CuCl2?2H2O 的溶解,提高产率,不能用热水洗涤CuCl2?2H2O,故答案为:防止Cu2+发生水解、减少CuCl2?2H2O 的溶解,提高产率;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 Na2S2O3 ~Cu2+
1 1
0.4000mol/L×0.0250L 0.01mol
则CuCl2?2H2O的物质的量为:0.01mol,
试样中CuCl2?2H2O的质量百分数为
| 0.01mol×171g/mol |
| 2.0g |
点评:本题涉及含铁物质间的转化以及根据化学方程式进行计算的知识,难度中等.

练习册系列答案
相关题目
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3区域的是 (3区域为除去1、2、4交叉部分)( )
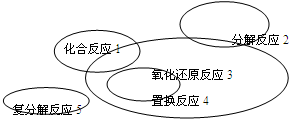

| A、Cl2+2KBr═Br2+2KCl | ||||
B、CaCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、2CuO+2CO
|
在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3?N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a%的是( )
| A、3mol H2和1mol N2 |
| B、2mol NH3和1mol N2 |
| C、2mol N2和3mol H2 |
| D、1mol NH3、1mol N2、3mol H2 |
 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.

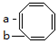
 )分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
)分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).