题目内容
 短周期元素X、Y、Z的位置如图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍.X、Y、Z三元素的元素符号是( )
短周期元素X、Y、Z的位置如图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍.X、Y、Z三元素的元素符号是( )| A、N、Si、S |
| B、O、P、C1 |
| C、F、S、Ar |
| D、C、A1、P |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z的位置可知,X处于第二周期,T、Z处于第三周期,设X的原子序数为x,则Y的原子序数为x+7,Z的原子序数为x+9,结合Y、Z两元素原子序数之和是X原子序数的4倍,列方程计算,进而推动元素.
解答:
解:由短周期元素X、Y、Z的位置可知,X处于第二周期,T、Z处于第三周期,设X的原子序数为x,则Y的原子序数为x+7,Z的原子序数为x+9,Y、Z两元素原子序数之和是X原子序数的4倍,故x+7+x+9=4x,解答x=8,故X为O元素、Y为P元素、Z为Cl,故选B.
点评:本题考查位置与结构的关系,注意理解掌握同主族元素性质的关系,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果正确的是( )| A、原混合酸中HNO3的物质的量为0.1 mol |
| B、OA段产生的是氢气,BC段产生NO |
| C、AB段的反应为Fe+2Fe(NO3)3═3 Fe(NO3)2 |
| D、H2SO4浓度为2.5 mol?L-1 |
已知下列热化学方程式:则14g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的△H约为( )
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol
Fe2O3(s)+
CO(g)═
Fe3O4(s)+
CO2(g)△H=-15.73kJ/mol
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol.
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol
Fe2O3(s)+
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol.
| A、-218 kJ/mol |
| B、-109 kJ/mol |
| C、+218 kJ/mol |
| D、+109 kJ/mol |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3区域的是 (3区域为除去1、2、4交叉部分)( )
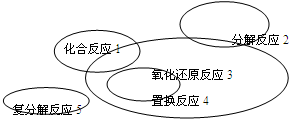

| A、Cl2+2KBr═Br2+2KCl | ||||
B、CaCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、2CuO+2CO
|
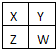 已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )| A、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸 |
| B、若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数) |
| C、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱 |
| D、若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应 |
杀虫剂“阿乐丹”的结构表示为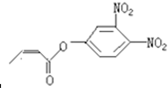 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A、遇FeCl3溶液均显紫色 |
| B、均能发生银镜反应 |
| C、均能与溴水发生反应 |
| D、均能与NaOH溶液发生反应下列 |
下列各组离子在相应的条件下一定能大量共存的是( )
| A、在碱性溶液中:HCO3-、K+、C1-、Na+ |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、K+、Na+、SO42- |
| C、在c(H+)/c(OH-)═1×1013的溶液中:NH4+、Br-、C1-、K+ |
| D、通有SO2的溶液中:Ca2+、C1-、NO3-、A13+ |
 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.