题目内容
 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:(1)判断装置的名称:A池为
(2)铁极为
(3)当C2极产生2.24L气体(标准状态)时,铁的质量变化(增加或减少)
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)该装置中A能自发的进行氧化还原反应为原电池,B为电解池;
(2)Fe易失电子作负极,C作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电,根据电极反应式确定反应的现象;
(3)根据电极反应式结合电子守恒来计算即可.
(2)Fe易失电子作负极,C作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电,根据电极反应式确定反应的现象;
(3)根据电极反应式结合电子守恒来计算即可.
解答:
解:(1)A能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)A中锌电极上失电子,是负极,发生氧化反应,Fe-2e-=Fe2+,石墨棒C2是阴极,该极上是氢离子得电子生成氢气的过程,会有气泡产生,氢离子减小,碱性增强,溶液变为红色,故答案为:负;Fe-2e-=Fe2+;有气泡产生,溶液变为红色;
(3)C2极上的反应:2H++2e-=H2↑,当产生2.24L即0.1mol气体(标准状态)时,转移电子是0.2mol,根据电极反应:Fe-2e-=Fe2+,铁的质量减少了0.1mol,即减小5.6g,根据电池反应式Fe+Cu2+=Cu+Fe2+,故生成铜单质是0.1mol,质量是6.4g,即CuSO4溶液的质量减少了6.4g-5.6g=0.8g,
故答案为:减少;5.6;减少;0.8.
(2)A中锌电极上失电子,是负极,发生氧化反应,Fe-2e-=Fe2+,石墨棒C2是阴极,该极上是氢离子得电子生成氢气的过程,会有气泡产生,氢离子减小,碱性增强,溶液变为红色,故答案为:负;Fe-2e-=Fe2+;有气泡产生,溶液变为红色;
(3)C2极上的反应:2H++2e-=H2↑,当产生2.24L即0.1mol气体(标准状态)时,转移电子是0.2mol,根据电极反应:Fe-2e-=Fe2+,铁的质量减少了0.1mol,即减小5.6g,根据电池反应式Fe+Cu2+=Cu+Fe2+,故生成铜单质是0.1mol,质量是6.4g,即CuSO4溶液的质量减少了6.4g-5.6g=0.8g,
故答案为:减少;5.6;减少;0.8.
点评:本题考查学生原电池、电解质的构成条件以及工作原理知识,注意电极反应式的书写是关键,难度中等.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列反应中,水为氧化剂的是( )
| A、Cl2+H2O═HCl+HClO |
| B、2Na+2H2O═2NaOH+H2↑ |
| C、P2O5+3H2O═2H3PO4 |
| D、3NO2+H2O═2HNO3+NO |
在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3?N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a%的是( )
| A、3mol H2和1mol N2 |
| B、2mol NH3和1mol N2 |
| C、2mol N2和3mol H2 |
| D、1mol NH3、1mol N2、3mol H2 |
苯环上有两个侧链烃基的有机物C12H18,其同分异构体的数目为(不考虑立体异构)( )
| A、39 | B、42 | C、45 | D、48 |
 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1. )分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
)分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).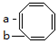
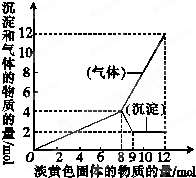 (1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.
(1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.