题目内容
19.下列关于硅酸的叙述,错误的是( )| A. | 硅酸是一种很弱的酸 | |
| B. | 硅酸可由二氧化硅与水反应制得 | |
| C. | 硅酸不稳定,加热脱水会生成二氧化硅 | |
| D. | 硅酸可以由可溶性硅酸盐与盐酸反应制得 |
分析 A、硅酸是一种不溶于水的二元弱酸;
B、二氧化硅不溶于水也不跟水反应;
C、硅酸受热分解生成二氧化硅和水;
D、硅酸的酸性弱于盐酸,应用强酸制弱酸.
解答 解:A、硅酸是一种不溶于水的二元弱酸,酸性非常弱,故A正确;
B、二氧化硅不溶于水也不跟水反应,所以二氧化硅与水不反应,故B错误;
C、硅酸受热分解生成二氧化硅和水,硅酸不稳定,故C正确;
D、硅酸的酸性弱于盐酸,应用强酸制弱酸,所以硅酸可以由可溶性硅酸盐与盐酸反应制得,故D正确;
故选B.
点评 本题考查二氧化硅及硅酸盐,明确二氧化硅的性质是解答本题的关键,注意硅及其化合物的用途,题目难度不大.

练习册系列答案
相关题目
9.如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)⑦的最低负价是-2;⑧的最高价含氧酸的化学式为HClO4.
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为 .
.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更容易与①的单质反应的是N2.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程 .
.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为
 .
.(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更容易与①的单质反应的是N2.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程
 .
.
11.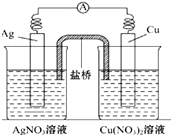 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )| A. | 在外电路中,电流由铜电极流向银电极 | |
| B. | 该装置是将电能转化为化学能 | |
| C. | 实验过程中取出盐桥,原电池仍继续工作 | |
| D. | 正极反应为:Ag++e-═Ag |
8.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是几种短周期元素的原子半径及主要化合价:
(1)A元素处于周期表中的位置是第三周期第IIA族.
(2)写出D离子的结构示意图 .
.
(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(4)C元素气态氢化物的电子式为 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
(2)写出D离子的结构示意图
 .
.(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(4)C元素气态氢化物的电子式为
 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 FeCl3溶液:K+、NH${\;}_{4}^{+}$、I-、SCN- | |
| B. | 使甲基橙试液呈红色的溶液:K+、Na+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13 mol•L-1的溶液中:Al3+、Ca2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液:NH${\;}_{4}^{+}$、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
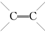 的化合物与CH2═CH2一样,在一定条件下可聚合成高分子化合物.
的化合物与CH2═CH2一样,在一定条件下可聚合成高分子化合物.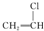 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是 .
.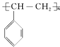 ),它是由
),它是由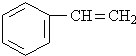 (写结构简式)聚合而成的.
(写结构简式)聚合而成的. ;
;