题目内容
9.如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为
 .
.(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更容易与①的单质反应的是N2.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程
 .
.
分析 由元素在周期表中的位置,可知①是H,②是Na,③是Mg,④是Al,⑤是C,⑥是N,⑦是O,⑧是Cl,⑨是Br,⑩是I.
(1)最低负化合价=主族族序数-8;⑧的最高价含氧酸为高氯酸;
(2)①和⑦两种元素的原子按1:1组成的常见化合物为H2O2;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)非金属性越强,单质与氢气反应越容易;
(5)②、④的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(6)③和⑨组成的化合物为NaBr,由钠离子与溴离子构成,用Na原子、Br原子电子式表示其形成.
解答 解:由元素在周期表中的位置,可知①是H,②是Na,③是Mg,④是Al,⑤是C,⑥是N,⑦是O,⑧是Cl,⑨是Br,⑩是I.
(1)⑦是O元素,最低负化合价=6-8=-2,⑧的最高价含氧酸为高氯酸,化学式为:HClO4,故答案为:-2;HClO4;
(2)①和⑦两种元素的原子按1:1组成的常见化合物为H2O2,电子式为 ,故答案为:
,故答案为: ;
;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+),
故答案为:r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+);
(4)氮的非金属性比碳强,因而其单质更易与氢气反应,故答案为:N2;
(5)②、④的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)③和⑨组成的化合物为MgBr2,由镁离子与溴离子构成,用Mg原子、Br原子电子式表示其形成为 ,
,
故答案为: .
.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意化学用语及规律性知识应用,题目难度不大.

| A. | NaOH溶液 | B. | 铁片 | C. | KSCN溶液 | D. | 石蕊溶液 |
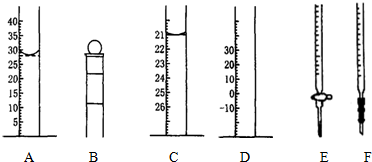
(1)A图中液面所示溶液的体积为28.0mL
(2)仪器E的名称是酸式滴定管
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2=S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液.
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂.
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色.
④重复滴定3次,数据记录于表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 氧化还原反应 | |
| B. | N2+3H2$?_{高温高压}^{催化剂}$2NH3可逆反应 | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 |
| A. | CH2═CH2分子中6个原子都共面,而CH3CH═CH2分子中最多有7个原子共面 | |
| B. | 苯是平面正六边形分子,其中存在单双键交替的结构 | |
| C. | 正戊烷分子中的碳原子之间以碳碳单键结合成直线状 | |
| D. | CH3Cl没有同分异构体说明CH4是正四面体结构,而非平面正方形 |
| A. | 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服重金属盐,立即服用牛奶或豆浆可解毒 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | 室温下,在水中的溶解度:甘油>苯酚>1-氯丁烷 |
| A. | 硅酸是一种很弱的酸 | |
| B. | 硅酸可由二氧化硅与水反应制得 | |
| C. | 硅酸不稳定,加热脱水会生成二氧化硅 | |
| D. | 硅酸可以由可溶性硅酸盐与盐酸反应制得 |
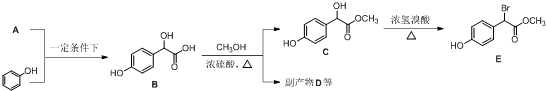
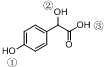 中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式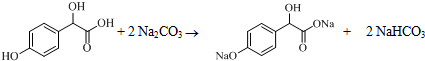 .
.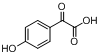 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$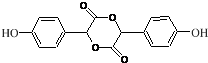 +2H2O.
+2H2O.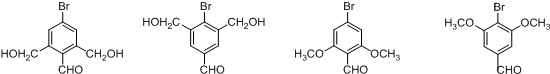 (不考虑立体异构).
(不考虑立体异构).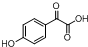 的合成路线图.
的合成路线图.