题目内容
8.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是几种短周期元素的原子半径及主要化合价:| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
(2)写出D离子的结构示意图
 .
.(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(4)C元素气态氢化物的电子式为
 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
分析 由于A的最高正价为+2,无最低负价,故和铍同一主族,故为Mg;B的最高正价为+3价,且半径比Mg小,比铍大,故为Al;C的最高正价为+5价,最低负价为-3价,且半径比铍还小,故为第二周期的N;D的最低负价为-2价,无最高正价,且半径比铍小,故为O;E的最高正价为+6,最低负价为-2价,故和O同为第VIA族,故为S;F的最高正价为+7,最低负价为-1价,故为第VIIA族,且由于原子半径比铍大,故为Cl,
(1)A为Mg,原子核外有3个电子层,最外层有2个电子;
(2)D离子为O2-,核外有10个电子,核内有8个质子;
(3)元素的非金属性越强,则最高价含氧酸的酸性越强;
(4)C元素气态氢化物为NH3,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,硝酸铵为离子化合物,结构中含离子键和共价键;
(5)B的最高价氧化物的水化物为氢氧化铝,E的最高价氧化物的水化物为硫酸,两者发生酸碱中和;
(6)同一周期的元素从左到右,非金属性逐渐增强,且非金属性越强,单质和氢气化合越容易,得到的气态氢化物越稳定,据此分析.
解答 解:由于A的最高正价为+2,无最低负价,故和铍同一主族,故为Mg;B的最高正价为+3价,且半径比Mg小,比铍大,故为Al;C的最高正价为+5价,最低负价为-3价,且半径比铍还小,故为第二周期的N;D的最低负价为-2价,无最高正价,且半径比铍小,故为O;E的最高正价为+6,最低负价为-2价,故和O同为第VIA族,故为S;F的最高正价为+7,最低负价为-1价,故为第VIIA族,且由于原子半径比铍大,故为Cl,
(1)A为Mg,原子核外有3个电子层,最外层有2个电子,故A在周期表中的位置为第三周期第IIA族,故答案为:第三周期第IIA族;
(2)D离子为O2-,核外有10个电子,核内有8个质子,故结构示意图为 ,故答案为:
,故答案为: ;
;
(3)元素的非金属性越强,则最高价含氧酸的酸性越强,而上述A~F六种元素中非金属性最强的为Cl,故其最高价含氧酸HClO4的酸性最强,故答案为:HClO4;
(4)C元素气态氢化物为NH3,电子式为: ,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为:
,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为: ;离子;离子键、共价键;
;离子;离子键、共价键;
(5)B的最高价氧化物的水化物为氢氧化铝,E的最高价氧化物的水化物为硫酸,两者发生酸碱中和,离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(6)同一周期的元素从左到右,非金属性逐渐增强,故Cl的非金属性强于S;且非金属性越强,单质和氢气化合越容易,得到的气态氢化物越稳定,但对氢化物溶于水后的酸性和沸点无关,故答案为:Cl;CD.
点评 本题考查学生元素周期表中元素分布以及元素周期律的知识,可以根据所学知识来回答,难度不大.

| A. | 硅酸是一种很弱的酸 | |
| B. | 硅酸可由二氧化硅与水反应制得 | |
| C. | 硅酸不稳定,加热脱水会生成二氧化硅 | |
| D. | 硅酸可以由可溶性硅酸盐与盐酸反应制得 |
已知:①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+.
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
(1)该电池的正极反应式为;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作965s.(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:
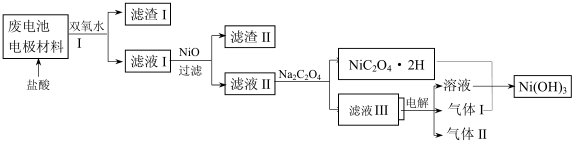
①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;,;将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).若两种沉淀都析出,pH应控制在不超过6.4(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
②滤液III中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解池阳极产生Cl2将NiC2O4氧化为Ni(OH)3.
| A. | 甲烷分子的球棍模型: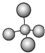 | |
| B. | $\underset{\stackrel{1}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$、$\underset{\stackrel{2}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$为同素异形体 | |
| C. | 离子结构示意图 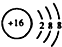 可以表示32S2-,又可以表示34S2- 可以表示32S2-,又可以表示34S2- | |
| D. | 中子数为146、质子数为92的铀(U)原子 14692U |
| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 非金属性:Cl>S>P>Si | ||
| C. | 酸性:H2SiO3>H2CO3>H3PO4 | D. | 热稳定性:PH3<H2S<HCl<HF |
| A. | 酒精和水 | B. | 乙酸和乙醇 | C. | 溴和四氯化碳 | D. | 水和四氯化碳 |
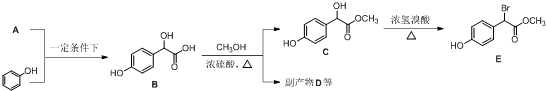
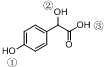 中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式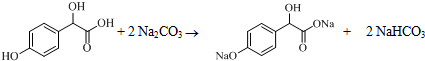 .
.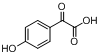 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$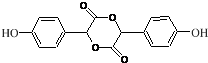 +2H2O.
+2H2O.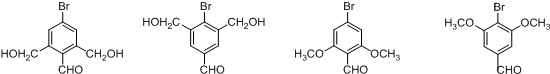 (不考虑立体异构).
(不考虑立体异构).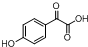 的合成路线图.
的合成路线图.