题目内容
14.SO2是无色有刺激性气味的有毒气体,是一种主要的气态污染物.某化学兴趣小组拟对SO2的化学性质和用途进行探究.(1)根据SO2中S元素的化合价,预测并通过实验验证SO2的性质.探究过程实验装置如图1所示(夹持仪器省略).
①A中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.B中溶液可验证SO2具有氧化性,若C中的是品红溶液,设计该装置的实验目的是验证SO2漂白的可逆性.
②在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
上述方案不合理的是方案一,原因是过量的SO2也能使酸性高锰酸钾溶液褪色.
(2)二氧化硫通常作为保护剂添加到葡萄酒中,有杀菌、抗氧化、改善风味和增酸的作用,但吸入过量的二氧化硫对人体有害.我国国家标准规定葡萄酒中SO2的最大使用量为0.25g/L.图2为该小组对葡萄酒中的SO2进行收集与测量的装置.
①仪器C的名称是冷凝器.
②A中加入200.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应.
③除去B中过量的H2O2,然后用0.0600mol/LNaOH标准溶液进行滴定,
滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量为0.192g/L.该测定结果比实际值偏高,原因是盐酸易挥发,挥发的HCl进入B中也会消耗NaOH
(3)该小组同学设想将SO2生产硫酸的反应设计成原电池(如图3),并采用串联方式来电解处理工业制硝酸尾气中的NO,可制得副产品NH4NO3.已知:每个电池中通入SO2的体积均为33.6L(标准状况),且反应完全.则电池中负极的电极反应式为SO2-2e-+2H2O=SO42-+4H+,电解池中阳极的电极反应式为NO-3e-+2H2O=NO3-+4H+,理论上最多能生成的NH4NO3的物质的量为1mol.

分析 (1)实验验证SO2的性质,实验中用浓硫酸与亚硫酸钠反应生成二氧化硫,验证二氧化硫的还原性用二氧化硫与氯化铁反应,再用二氧化硫与硫化钠反应验证二氧化硫的氧化性,最后在有水浴的装置中验证二氧化硫的漂白的可逆性,D装置用氢氧化钠吸收二氧化硫;
①A中发生反应为二氧化硫与氯化铁反应生成亚铁离子和硫酸根离子;
②过量的二氧化硫能溶于水,能和高锰酸钾发生氧化还原反应,高锰酸钾是强氧化剂把二氧化硫氧化为硫酸,高锰酸钾褪色;
(2)①根据仪器A特点和用途书写其名称;
③根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;盐酸易挥发,挥发的HCl进入B中也会消耗NaOH导致测定结果比实际值偏高;
(3)原电池中在负极失电子发生氧化反应,正极上得到电子发生还原反应;将SO2生产硫酸的反应设计成原电池,负极为二氧化硫失去电子生成硫酸;采用串联方式来电解处理工业制硝酸尾气中的NO,电解阳极发生氧化反应,阴极发生还原反应,阳极为一氧化氮失去电子生成硝酸根离子,根据得失电子守恒计算理论上最多能生成的NH4NO3的物质的量.
解答 解:(1)①A中发生反应为二氧化硫与氯化铁反应生成亚铁离子和硫酸根离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++4H++SO42-,B中二氧化硫(S为+4价)与硫化钠反应生成硫单质(S为0价),二氧化硫表现氧化性,验证二氧化硫的氧化性,C中的是品红溶液,二氧化硫能使品红褪色,水浴加热,能恢复原颜色,可验证二氧化硫的漂白的可逆性,
故答案为:2Fe3++SO2+2H2O=2Fe2++4H++SO42-;氧化;验证SO2漂白的可逆性;
②二氧化硫有还原性,高锰酸钾有强氧化性,过量的二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,所以方案一不合理,
故答案为:方案一;过量的SO2也能使酸性高锰酸钾溶液褪色;
(2)①根据仪器A的构造可知,仪器A为冷凝管,冷凝葡萄酒中的易挥发易冷凝的物质,
故答案为:冷凝器;
②根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0600mol/L×0.020L)×64g/mol=0.0384g,该葡萄酒中的二氧化硫含量为:$\frac{0.0384g}{0.2L}$=0.192g/L,由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高,
故答案为:0.192;盐酸易挥发,挥发的HCl进入B中也会消耗NaOH;
(3)将SO2生产硫酸的反应设计成原电池,负极为二氧化硫失去电子生成硫酸,反应为:SO2-2e-+2H2O=SO42-+4H+,采用串联方式来电解处理工业制硝酸尾气中的NO,电解阳极发生氧化反应,为一氧化氮失去电子生成硝酸根离子,反应为:NO-3e-+2H2O=NO3-+4H+,每个电池中通入SO2的体积均为33.6L(标准状况),且反应完全.n(SO2)=$\frac{33.6L}{22.4L/mol}$=1.5mol,SO2-2e-+2H2O=SO42-+4H+,转移3mol电子,根据NO-3e-+2H2O=NO3-+4H+可知,生成1mol硝酸铵,
故答案为:SO2-2e-+2H2O=SO42-+4H+;NO-3e-+2H2O=NO3-+4H+;1mol.
点评 本题考查了有关SO2的化学性质和用途探究实验,试题涉及了二氧化硫性质、氧化还原、电化学等知识,明确二氧化硫的化学性质及原电池、电解池的工作原理是解答关键,试题培养了学生灵活应用所学知识的能力,题目难度中等.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | X与Z均只能形成一种氧化物 | |
| B. | 离子半径r(Y)<r(Z) | |
| C. | W的最高价氧化物对应的水化物是强酸 | |
| D. | Y的气态氢化物的热稳定性比W的弱 |
| A. | 氢氧化镁、氢氧化钾、氢氧化铁、氢氧化镁等碱不溶于水,统称为难溶性碱 | |
| B. | 科学家合成和分离了超过4500万种物质.尿素是第一个人工合成的无机化合物,尿素的合成是无机化学发展过程中的重要里程碑和分水岭 | |
| C. | 金刚石、食盐、冰都属于晶体,有固定熔沸点,而石蜡、玻璃属于非晶体,一般不具备规则的几何外形 | |
| D. | 固体微粒排列紧密,在固定的位置上振动,几乎不能被压缩,而液体微粒可自由移动,易被压缩 |
| A. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 |
| A. | 加入催化剂会改变反应的焓变 | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |
| D. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是不相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,实际有漂白作用的物质是氯气 | |
| D. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,说明BaCl2溶液具有酸性 |
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 纯碱 | Al(OH)3胶体 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 小苏打 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | B. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$ 2 Fe+3CO2 | D. | MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ |
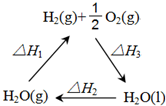 盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.