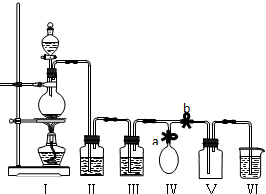
题目内容
10.实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,该反应的化学方程式为KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3Cl2↑+KCl+3H2O.(1)浓盐酸在此反应中所具有的性质是②(填写编号).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.3mol Cl2,反应中转移的电子数是0.5NA,消耗还原剂的物质的量是0.5mol.
(3)若反应中HCl的利用率为50%,当反应结束时,生成氯气10.65g,求浓盐酸的物质的量浓度(写出计算过程).
分析 (1)生成氯气时Cl元素的化合价变化,生成KCl体现酸性;
(2)由反应可知,生成3mol气体转移5mol电子,消耗还原剂HCl为5mol;
(3)根据氯气物质的量计算参加反应HCl的物质的量,再根据HCl利用率计算盐酸中HCl总物质的量,根据c=$\frac{n}{V}$计算盐酸物质的量浓度.
解答 解:(1)HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又生成盐KCl,则表现酸的酸性,则浓盐酸具体还原性和酸性,
故答案为:②;
(2)由反应可知,生成3mol气体转移5mol电子,消耗还原剂HCl为5mol,则产生0.3mol Cl2,反应中转移的电子数是0.5NA,消耗还原剂的物质的量是0.5mol,
故答案为:0.5NA;0.5mol;
(3)n(Cl2)=$\frac{10.65g}{71g/mol}$=0.15mol,根据KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O,可知反应的HCl的物质的量为0.15mol×$\frac{6}{3}$=0.3mol,HCl的利用率只有50%,则盐酸中HCl总物质的量为$\frac{0.3mol}{50%}$=0.6mol,故盐酸物质的量浓度为$\frac{0.6mol}{0.05L}$=12mol/L,
答:浓盐酸的物质的量浓度为12mol/L.
点评 本题考查氧化还原反应计算,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意物质的量相关计算,题目难度不大.

练习册系列答案
相关题目
1.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA | |
| D. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
18.下列叙述不正确的是( )
| A. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| B. | 酸雨的PH小于5.6 | |
| C. | SO2可以用作食物和干果的防腐剂 | |
| D. | 铵盐受热易分解,都生成氨气和对应的酸 |
5.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色 |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.比较AgCl和AgI的 Ksp大小 | 向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,观察现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
15.分子有极性分子和非极性分子.下列对极性分子和非极性分子的认识正确的是( )
| A. | 含非极性键的分子一定是非极性分子 | |
| B. | 含有极性键的分子一定是极性分子 | |
| C. | 非极性分子一定含有非极性键 | |
| D. | 极性分子不一定只含有极性键 |
2.在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
则下列说法中正确的是( )
| 物质 | A | B | C | D |
| 反应前质量(g) | 4 | 6 | 111 | 4 |
| 反应后质量(g) | 待测 | 15 | 0 | 84 |
| A. | 该反应的反应物为A和C | |
| B. | 容器中发生的化学反应,属于分解反应 | |
| C. | 反应后,生成了84g D物质 | |
| D. | 反应后,待测A的质量为26 g |
19.下列装置应用于实验室进行相关实验,能达到实验目的是( )
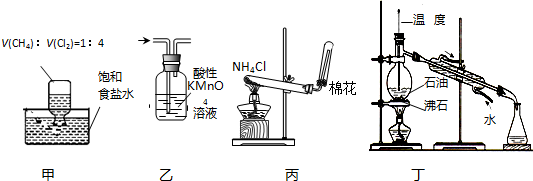

| A. | 用装置甲在光照条件下验证甲烷与氯气的反应 | |
| B. | 用装置乙除去甲烷中少量的乙烯得纯净甲烷 | |
| C. | 装置丙用于实验室制取NH3 | |
| D. | 用装置丁分馏石油并收集60~150℃馏分 |