题目内容
8.将一定量的镁、铝合金溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如图所示.下列说法中错误的是( )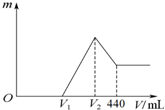
| A. | V2=400mL | |
| B. | 0≤V1<280mL | |
| C. | 加入NaOH溶液的过程中,产生沉淀的最大量可能为0.18mol | |
| D. | 当V1=160mL时,n(Mg)=0.04mol |
分析 根据图象可知,在滴加NaOH溶液到体积V1mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,当滴加NaOH溶液到体积V2时,沉淀最大为Mg(OH)2、Al(OH)3,此时溶液中溶质为Na2SO4,加入440mLNaOH溶液时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
A.根据硫酸根守恒:n(Na2SO4)=n(H2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),进而计算NaOH溶液体积;
B.结合A中计算可知溶解氢氧化铝消耗氢氧化钠的物质的量,结合Al(OH)3+NaOH=NaAlO2+2H2O计算氢氧化铝的物质的量,根据Al元素守恒计算n(Al),混合物中没有Mg时剩余硫酸最大,即V1到达极大值,硫酸没有剩余时V1值最小;
C.由于溶液中铝离子是确定的,故当V1=0时,生成沉淀达极大值,计算Mg的物质的量,进而计算沉淀最大量;
D.镁离子、铝离子沉淀消耗NaOH溶液体积为(V2-V1)mL,根据电荷守恒可知:2n(Mg2+)+3n(Al3+)=n(OH-),结合元素守恒计算Mg的物质的量.
解答 解:根据图象可知,在滴加NaOH溶液到体积V1mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,当滴加NaOH溶液到体积V2时,沉淀最大为Mg(OH)2、Al(OH)3,此时溶液中溶质为Na2SO4,加入440mLNaOH溶液时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
A.当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据硫酸根守恒:n(Na2SO4)=n(H2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),故n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以V(NaOH)=$\frac{0.4mol}{1mol/L}$=0.4L=400mL,故A正确;
B.溶解氢氧化铝消耗NaOH为(0.44-0.4)L×1mol/L=0.04mol,由Al(OH)3+NaOH=NaAlO2+2H2O,可知Al(OH)3为0.04mol,故混合物中Al为0.04mol,混合物中没有Mg时剩余硫酸最大,即V1到达极大值,Al消耗硫酸为0.04mol×$\frac{3}{2}$=0.06mol,则金属反应后剩余硫酸为0.1L×2mol/L-0.06mol=0.14mol,故中和剩余的硫酸需要NaOH为0.14mol×2=0.28mol,NaOH溶液体积为$\frac{0.28mol}{1mol/L}$=0.28L=280mL,硫酸没有剩余时V1值最小,故0≤V1<280mL,故B正确;
C.由于溶液中铝离子是确定为0.04mol,故当V1=0时,生成沉淀达极大值,0.14mol硫酸可以溶解Mg为0.14mol,根据原子守恒可知,生成沉淀最大量为0.14mol+0.04mol=0.18mol,故C正确;
D.镁离子、铝离子沉淀消耗NaOH为(0.4-0.16)L×1mol/L=0.24mol,根据电荷守恒可知:2n(Mg2+)+3n(Al3+)=n(OH-),故2n(Mg2+)+3×0.04mol=0.24mol,解得n(Mg2+)=0.06mol,故n(Mg)=0.06mol,故D错误.
故选:D.
点评 本题以图象形式考查混合物计算,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想与极限法的运用,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 胆矾 | 干冰 |
| B | 液氨 | 漂白粉 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 苛性钠 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 13.2g | B. | 20.1g | C. | 22.0g | D. | 24.0g |
| A. | Na2CO3 | B. | Na2O2 Na2CO3 | ||
| C. | NaOH Na2CO3 | D. | Na2O2 NaOH Na2CO3 |
| A. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| B. | 酸雨的PH小于5.6 | |
| C. | SO2可以用作食物和干果的防腐剂 | |
| D. | 铵盐受热易分解,都生成氨气和对应的酸 |
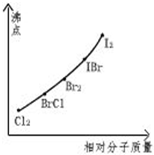 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题: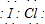 ,写出该物质与NaOH溶液反应的化学方程式2NaOH+ICl═NaCl+NaIO+H2O
,写出该物质与NaOH溶液反应的化学方程式2NaOH+ICl═NaCl+NaIO+H2O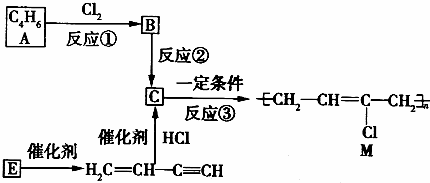
 .
.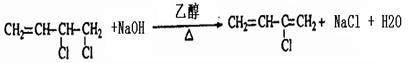 .
. 、
、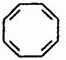 .鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.
.鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.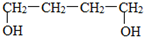 ),其反应步骤为:(第一、三步用化学方程式表示)
),其反应步骤为:(第一、三步用化学方程式表示)