题目内容
9.现将标准状况下的2.24L HCl气体溶解在含有0.2mol醋酸钠溶液的烧杯中,测得溶液体积为1L.若此溶液中c(CH3COO-)>c(Cl-),则下列判断中不正确的是( )| A. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | 温度为298 K时,pH<7 |
分析 将标准状况下的2.24L HCl(0.1mol)气体溶解在含有0.2mol醋酸钠溶液的烧杯中,制得1L溶液,溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),则说明醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,据此结合物料守恒、电荷守恒进行判断.
解答 解:将标准状况下的2.24L HCl(0.1mol)气体溶解在含有0.2mol醋酸钠溶液的烧杯中,制得1L溶液,溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),
A.由电荷守恒可知c(CH3COO-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),c(Na+)=0.2mol/L,c(Cl-)0.1mol/L,则c(CH3COO-)+c(OH-)=0.2mol/L-0.1mol/L+c(H+)>0.10mol•L-1,c(CH3COO-)+c(OH-)>0.10mol•L-1,故A错误;
B.根据物料守恒得:c(CH3COOH)+c(CH3COO-)=0.20mol•L-1,故B正确;
C.醋酸的电离程度大于醋酸根离子的水解程度,所以c(CH3COOH)<c(CH3COO-),故C正确;
D.溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),则说明醋酸的电离程度大于醋酸根离子的水解程度,则溶液呈酸性,即溶液的pH小于7,故D正确;
故选A.
点评 本题考查离子浓度大小的比较,题目难度中等,明确溶液中的溶质及其醋酸的电离程度大于醋酸根离子的水解程度是解本题关键,利用电荷守恒和物料守恒进行分析解答.

 名校课堂系列答案
名校课堂系列答案| A. | Na2CO3 | B. | Na2O2 Na2CO3 | ||
| C. | NaOH Na2CO3 | D. | Na2O2 NaOH Na2CO3 |
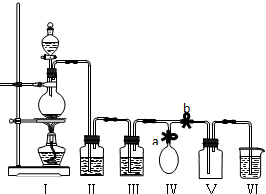
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |

实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
| A. | XY2Z3 | B. | X2YZ3 | C. | X3YZ4 | D. | X3YZ3 |
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA | |
| D. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
| A. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| B. | 酸雨的PH小于5.6 | |
| C. | SO2可以用作食物和干果的防腐剂 | |
| D. | 铵盐受热易分解,都生成氨气和对应的酸 |

| A. | 用装置甲在光照条件下验证甲烷与氯气的反应 | |
| B. | 用装置乙除去甲烷中少量的乙烯得纯净甲烷 | |
| C. | 装置丙用于实验室制取NH3 | |
| D. | 用装置丁分馏石油并收集60~150℃馏分 |

 .
. .
. 、
、 .鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.
.鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液. ),其反应步骤为:(第一、三步用化学方程式表示)
),其反应步骤为:(第一、三步用化学方程式表示)