题目内容
5.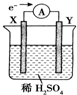 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中,SO42-朝Y极移动 | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
分析 根据图片知,该装置是原电池,根据电子的流向判断正负极,电解质溶液中阴离子移向负极;较活泼的金属作负极,不活泼的金属或导电的非金属作正极;负极上发生氧化反应,正极上发生还原反应.
解答 解:A.根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,X为原电池的负极,电解质溶液中阴离子移向X极,故A错误;
B.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;
C.X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,故C错误;
D.原电池中较活泼的金属作负极,较不活泼的金属作正极,该原电池中X是负极,Y是正极,所以它们的活动性顺序为X>Y,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,会根据电子的流向判断原电池的正负极是解本题的关键,明确正负极的判断方法、正负极上发生反应的类型、电子和电解质溶液中的离子运动方向即可解答本题.

练习册系列答案
相关题目
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. | 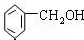 苯甲醇 苯甲醇 |
10.我国市售加碘食盐中含有碘酸钾.已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:
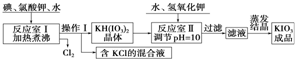
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②除去反应生成的氯气,有利于反应正反应方向进行
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
由上表数据分析可知,操作Ⅰ的名称为冷却结晶、过滤.
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是使KH(IO3)2转化为KIO3.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为85.6%(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2=2I2+2H2O.
②根据乙同学的实验结果推测,甲同学的实验结果会偏大(填“偏大”,“偏小”或“无影响”).

请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②除去反应生成的氯气,有利于反应正反应方向进行
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是使KH(IO3)2转化为KIO3.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为85.6%(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会偏大(填“偏大”,“偏小”或“无影响”).
17.已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是( )
| A. | 该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O | |
| B. | 该反应中的氧化剂是H2O2,还原产物是O2 | |
| C. | 氧化性:H2CrO4>O2 | |
| D. | 如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L |
14.已知只有质子数或中子数为奇数的原子核有核磁共振(NMR)现象,试判断下列哪组原子均可产生NMR现象( )
| A. | 18O 31P 35Cl | B. | 27Al 19F 12C | ||
| C. | 第一周期所有元素的原子 | D. | 元素周期表中ⅤA所有元素的原子 |
15.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |


