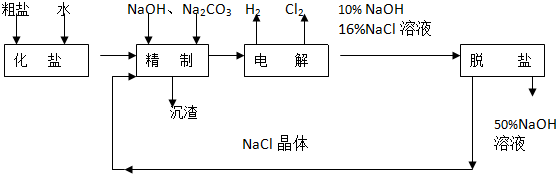
题目内容
17.已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是( )| A. | 该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O | |
| B. | 该反应中的氧化剂是H2O2,还原产物是O2 | |
| C. | 氧化性:H2CrO4>O2 | |
| D. | 如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L |
分析 由H2O2只发生如下过程H2O2-→O2可知,反应中过氧化氢为还原剂,氧气为氧化产物,则H2CrO4为氧化剂,对应产物Cr(OH)3为还原产物,结合氧化还原反应得失电子守恒及原子个数守恒书写方程式,再根据氧化还原反应原理分析.
解答 解:由题意:H2O2只发生如下过程H2O2→O2可知,反应中过氧化氢为还原剂,氧气为氧化产物,则H2CrO4为氧化剂,对应产物Cr(OH)3为还原产物,H2O2-→O2化合价升高2,H2CrO4→Cr(OH)3化合价降3,依据得失电子守恒,H2O2系数为3,依据原子个数守恒,H2CrO4系数为2,O2系数为3,Cr(OH)3系数为2,产物中生成2分子水,化学方程式为:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,故A正确;
B.H2O2→O2可知,O元素的化合价升高,则反应中过氧化氢为还原剂,氧气为氧化产物,故B错误;
C.反应中氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:H2CrO4>O2,故C正确;
D.2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O中转移6mol电子生成3mol气体,所以转移0.3mol电子时生成0.15mol气体,气体在标准状况下体积为3.36 L,故D正确.
故选B.
点评 本题考查了氧化还原反应方程式的配平、氧化性的比较、氧化还原反应基本概念等,明确反应中元素化合价的变化是解题的关键,依据得失电子守恒、原子个数守恒即可解答,题目难度不大.

练习册系列答案
相关题目
8.关于1L 0.1mol/L 的(NH4)2Fe(SO4)2溶液,下列说法正确的是( )
| A. | Cl-、I-、Na+能在该溶液中大量共存 | |
| B. | 通入H2S气体,发生反应的离子方程式为:H2S+Fe2+═FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | 和少量的NaOH溶液充分反应并加热,可生成标准状况下的NH3 4.48L |
5.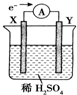 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中,SO42-朝Y极移动 | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
12.下列叙述中正确的是( )


| A. | 图①中正极附近溶液pH减小 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②正极反应是O2+2H2O+4e-═4OH- | |
| D. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
9. 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
d.NaHCO3; pH由小到大的排列顺序是(填序号)a<d<c<b.
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,
下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-)
D.c(OH-)/c(H+) E.c(H+)•c(CH3COO-)/c(CH3COOH)
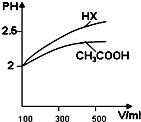
(3)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX)> Ka(CH3COOH)(填>、<或=).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中自由离子浓度的从大到小
的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
d.NaHCO3; pH由小到大的排列顺序是(填序号)a<d<c<b.
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,
下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-)
D.c(OH-)/c(H+) E.c(H+)•c(CH3COO-)/c(CH3COOH)
(3)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX)> Ka(CH3COOH)(填>、<或=).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中自由离子浓度的从大到小
的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
6.在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A. | 反应中KMnO4被氧化 | |
| B. | HCl发生还原反应 | |
| C. | 每消耗2mol HCl时,反应中转移的电子为2 mol | |
| D. | 氧化剂与还原剂的物质的量之比为1﹕5 |
7.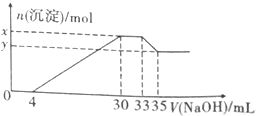 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |