题目内容
3.如表由实验现象得出的结论正确的是( )| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生沉淀的转化,生成更难溶的物质;
B.滴加氯水后再加入KSCN溶液,亚铁离子可被氯气氧化;
C.溶液上层呈橙红色,可知氯气氧化溴离子;
D.加热氯化铵分解.
解答 解:A.发生沉淀的转化,生成更难溶的物质,由现象可知生成AgI沉淀,则Ksp(AgCl)>Ksp(AgI),故A错误;
B.滴加氯水后再加入KSCN溶液,亚铁离子可被氯气氧化,原溶液中可能含Fe2+,或含Fe3+,或二者均含,故B错误;
C.溶液上层呈橙红色,可知氯气氧化溴离子,由氧化还原反应中还原剂的还原性大于还原产物的还原性可知,Br-还原性强于Cl-,故C正确;
D.加热时氯化铵分解,在试管口HCl与氨气化合生成氯化铵,与升华无关,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握沉淀的转化、离子检验、物质的性质、现象与结论的关系、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
14. 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )| A. | 能发生取代反应、加成反应、消去反应 | |
| B. | 1mol该物质中含有苯环的物质的量为1mol | |
| C. | 该物质在酸性条件下加热水解可以得到乙醇 | |
| D. | 与足量NaOH溶液反应,最多消耗4nmolNaOH |
18.香叶醛(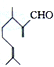 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(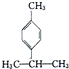 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
8.X、Y、Z、W是原子序数依次增大的短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 元素Y分别与元素Z、W形成的化合物中化学键类型相同 | |
| C. | 元素Z和元素Y、W均能形成离子化合物 | |
| D. | 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物 |
12.下列实验装置能达到实验目的是( )


| A. | 图①装置可用于配制 100 mL 0.1 mol/L的硫酸 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
13.某种食用精制盐包装袋上有如表说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.




