题目内容
研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ?mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则CO还原Fe2O3(s)的热化学方程式为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=
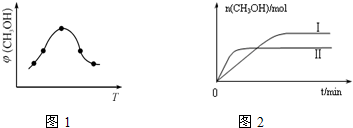
②取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应.反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ
(3)以CO2为原料还可以合成多种物质.
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为
| n(NH3) |
| n(CO2) |
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为
考点:热化学方程式,反应热和焓变,常见化学电源的种类及其工作原理,化学平衡常数的含义,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①依据化学方程式和平衡常数概念写出平衡常数表达式;
②由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高温度平衡向逆反应进行,据此判断;
③由图象分析先拐先平,温度高TⅡ先达到平衡则TⅡ>TⅠ,纵轴是甲醇的物质的量,温度越高,甲醇越少,平衡逆向进行分析判断;
(3)①根据反应物、反应条件、生成物写出化学反应式;利用三段式法计算;
②根据原电池原理,CO2在正极发生还原反应转化为甲烷,注意电解质溶液为酸性.
(2)①依据化学方程式和平衡常数概念写出平衡常数表达式;
②由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高温度平衡向逆反应进行,据此判断;
③由图象分析先拐先平,温度高TⅡ先达到平衡则TⅡ>TⅠ,纵轴是甲醇的物质的量,温度越高,甲醇越少,平衡逆向进行分析判断;
(3)①根据反应物、反应条件、生成物写出化学反应式;利用三段式法计算;
②根据原电池原理,CO2在正极发生还原反应转化为甲烷,注意电解质溶液为酸性.
解答:
解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
,
故答案为:
;
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,
故答案为:<;
③由图2可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以KⅠ>KⅡ,
故答案为:>;
(3)①根据反应物是二氧化碳和氨气(NH3),反应条件是高温、高压,生成物是尿素[CO(NH2)2]和水,化学反应式为2NH3+CO2 CO(NH2)2+H2O,
CO(NH2)2+H2O,
设CO2的初始物质的量为a,则NH3的初始物质的量为3a,
2NH3+CO2 CO(NH2)2+H2O;
CO(NH2)2+H2O;
起始/mol 3a a
转化/mol 1.2a 0.6a
平衡/mol 1.8a 0.4a
平衡时NH3转化率为:
×100%=40%,
故答案为:2NH3+CO2 CO(NH2)2+H2O;40%;
CO(NH2)2+H2O;40%;
②CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e-+8H+=CH4+2H2O,
故答案为:CO2+8e-+8H+=CH4+2H2O.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
故答案为:
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,
故答案为:<;
③由图2可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以KⅠ>KⅡ,
故答案为:>;
(3)①根据反应物是二氧化碳和氨气(NH3),反应条件是高温、高压,生成物是尿素[CO(NH2)2]和水,化学反应式为2NH3+CO2
 CO(NH2)2+H2O,
CO(NH2)2+H2O,设CO2的初始物质的量为a,则NH3的初始物质的量为3a,
2NH3+CO2
 CO(NH2)2+H2O;
CO(NH2)2+H2O;起始/mol 3a a
转化/mol 1.2a 0.6a
平衡/mol 1.8a 0.4a
平衡时NH3转化率为:
| 1.2a |
| 3a |
故答案为:2NH3+CO2
 CO(NH2)2+H2O;40%;
CO(NH2)2+H2O;40%;②CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e-+8H+=CH4+2H2O,
故答案为:CO2+8e-+8H+=CH4+2H2O.
点评:本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与.

练习册系列答案
相关题目
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A、氢化物的稳定性:HnX>HnW,是因为HnX 分子间存在氢键 |
| B、原子序数:W>Y>Z>X |
| C、离子的还原性:X>W |
| D、原子半径:Y>Z>X |
已知元素R的某种核素的氯化物RClx由Rx+与Cl-构成,Rx+的核外电子数为z,核内中子数为y,则该核素的组成符号为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列反应的离子方程式正确的是( )
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-=I2+2OH- |
| B、氯化铝溶液中滴加适量的NaF溶液:Al3++3F-+3H2O=Al(OH)3↓+3HF↑ |
| C、向CuSO4溶液中滴加氨水至过量:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+ |
D、水杨酸与足量NaHCO3溶液反应: |
“环境问题”是当今全球共同关注的焦点,在刚刚闭幕的哥本哈根气候大会上中国发挥了重要的作用.下列对厦门环境造成危害的一组主要污染物是( )
| A、CO2、SO2、O2 |
| B、CO2、N2、O2 |
| C、SO2、NO2、可吸入颗粒物 |
| D、NO2、N2、可吸入颗粒物 |