题目内容
工业上制备BaCl2的工艺流程图如下: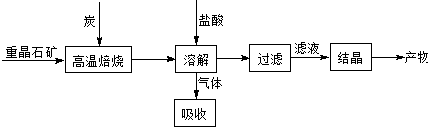
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是 (填序号)
A.硫化钠在水溶液中水解生成了NaOH和H2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO2而放出H2S气体
(2)向同物质的量浓度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成 沉淀,当
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
会 (填变大、变小、始终不变).
[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)
2CO(g)的△H= kJ?mol-1.
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 .

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
| 高温 |
BaSO4(s)+2C(s)
| 高温 |
(1)气体用过量NaOH溶液吸收,得到硫化钠.一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是
A.硫化钠在水溶液中水解生成了NaOH和H2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO2而放出H2S气体
(2)向同物质的量浓度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成
| c(Br-) |
| c(Cl-) |
| c(Br-) |
| c(Cl-) |
[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)
| 高温 |
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
考点:反应热和焓变,难溶电解质的溶解平衡及沉淀转化的本质,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)硫化钠溶液水解呈碱性,吸收二氧化碳会促进水解;
(2)溶度积小的先沉淀;根据溶度积常数计算
;根据影响溶度积常数的因素分析;
(3)利用盖斯定律计算反应热;
(4)加入过量C可提高冰晶石的转化率,同时维持反应进行.
(2)溶度积小的先沉淀;根据溶度积常数计算
| c(Br-) |
| c(Cl-) |
(3)利用盖斯定律计算反应热;
(4)加入过量C可提高冰晶石的转化率,同时维持反应进行.
解答:
解:(1)硫化钠溶液水解:S2-+H2O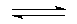 HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O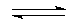 H2S+OH-,呈碱性,吸收二氧化碳会促进水解生成硫化氢气体;
H2S+OH-,呈碱性,吸收二氧化碳会促进水解生成硫化氢气体;
故答案为:C;
(2)溶度积小的先沉淀已知AgBr的溶度积小,所以AgBr先沉淀;当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
,c(Cl-)=
,则
=
=2.7×10-3;开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以AgCl为主,
=
,Ksp只与温度有关,温度不变Ksp不变,所以
会始终不变;
故答案为:AgBr;2.7×10-3;AgCl; 始终不变;
(3)利用盖斯定律求解:
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)
2CO(g)△H=
=+172.5kJ?mol-1,
故答案为:+172.5;
(4)加入过量C可提高冰晶石的转化率,以上反应为吸热反应,炭和氧气反应放热维持反应所需高温;
故答案为:使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温.
故答案为:C;
(2)溶度积小的先沉淀已知AgBr的溶度积小,所以AgBr先沉淀;当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
| Ksp(AgBr) |
| c(Ag+) |
| Ksp(AgCl) |
| c(Ag+) |
| c(Br-) |
| c(Cl-) |
| 5.4×10-13 |
| 2.0×10-10 |
| c(Br-) |
| c(Cl-) |
| Ksp(AgBr) |
| Ksp(AgCl) |
| c(Br-) |
| c(Cl-) |
故答案为:AgBr;2.7×10-3;AgCl; 始终不变;
(3)利用盖斯定律求解:
BaSO4(s)+4C(s)
| ||
BaSO4(s)+2C(s)
| ||
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)
| ||
| 571.2kJ?mol-1-226.2kJ?mol-1 |
| 2 |
故答案为:+172.5;
(4)加入过量C可提高冰晶石的转化率,以上反应为吸热反应,炭和氧气反应放热维持反应所需高温;
故答案为:使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温.
点评:本题考查较为综合,题目具有一定难度,涉及盐类的水解、难溶电解质的溶解平衡、反应热的计算等问题,本题注意溶度积常数的利用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
无色的有机物Ⅰ是印制防伪商标的一种原料,在紫外光辐射下I可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):

有关上述变化的说法正确的是( )

有关上述变化的说法正确的是( )
| A、Ⅰ属于芳香烃 |
| B、被Cl2熏蒸过的商标将失去防伪能力 |
| C、Ⅰ和Ⅱ互为同分异构体 |
| D、若R1、R2、R3都是甲基,Ⅱ的分子是C26H24O3 |
下列离子方程式正确的是( )
| A、MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| B、FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ |
| C、酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2=I2+2H2O |
| D、氯化铝溶液中滴加氨水:Al3++4OH-=AlO2-+2H2O |
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、将1 mol BaCl2 溶于水所形成的溶液中含NA个氯离子 |
| B、标准状况下,22.4 L CO2所含的分子数为NA |
| C、2克氢气所含原子数约为6.02×1023 |
| D、1mol Na完全反应得到电子数为 NA |