题目内容
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A、氢化物的稳定性:HnX>HnW,是因为HnX 分子间存在氢键 |
| B、原子序数:W>Y>Z>X |
| C、离子的还原性:X>W |
| D、原子半径:Y>Z>X |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z均为短周期元素,W的原子最外层电子数与核外电子总数之比为7:17,应为Cl元素;X与W同主族,则X为F元素;Y的原子序数是W和X的原子序数之和的一半,Y原子序数应为
=14,为Al元素;含Z元素的物质焰色反应为黄色,应为Na元素,结合元素化合物的性质以及元素周期律的递变规律解答.
| 17+9 |
| 2 |
解答:
解:W、X、Y、Z均为短周期元素,W的原子最外层电子数与核外电子总数之比为7:17,应为Cl元素;X与W同主族,则X为F元素;Y的原子序数是W和X的原子序数之和的一半,Y原子序数应为
=14,为Al元素;含Z元素的物质焰色反应为黄色,应为Na元素,
A.氢键会影响物理性质,氢化物的稳定性:HF>HCl,是由于H-F键比H-Cl键稳定,故A错误;
B.W为Cl、X为F、Y为Al、Z为Na,原子序数W>Y>Z>X,故B正确;
C.非金属性F>Cl,故离子还原性Cl->F-,故C错误;
D.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>F,故D错误,
故选B.
| 17+9 |
| 2 |
A.氢键会影响物理性质,氢化物的稳定性:HF>HCl,是由于H-F键比H-Cl键稳定,故A错误;
B.W为Cl、X为F、Y为Al、Z为Na,原子序数W>Y>Z>X,故B正确;
C.非金属性F>Cl,故离子还原性Cl->F-,故C错误;
D.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>F,故D错误,
故选B.
点评:本题考查结构性质位置关系应用,推断元素是解题的关键,注意掌握核外电子排布与元素周期律,难度中等.

练习册系列答案
相关题目
下列各组离子在水溶液中能大量共存的是( )
| A、K+、H+、SiO32-、S2- |
| B、Na+、K+、OH-、SO32- |
| C、Na+、Cl-、H+、ClO- |
| D、Na+、H+、I-、NO3- |
pH为2的氢氟酸稀释100倍后,pH<4.则25°C时,将0.1mol?L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
⑤
.
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L SO3含有0.5NA SO3分子 |
| B、7.8g Na2O2与足量CO2反应,转移的电子数为0.1NA |
| C、1mol C5H12中含有的共价键数为17NA |
| D、1L 0.1mol?L-1的Na2S溶液中含有0.1NA S2-离子 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:Al+2OH-═AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、钠和冷水反应:2Na+2H2O═2Na++2OH-+H2↑ |
无色的有机物Ⅰ是印制防伪商标的一种原料,在紫外光辐射下I可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):

有关上述变化的说法正确的是( )

有关上述变化的说法正确的是( )
| A、Ⅰ属于芳香烃 |
| B、被Cl2熏蒸过的商标将失去防伪能力 |
| C、Ⅰ和Ⅱ互为同分异构体 |
| D、若R1、R2、R3都是甲基,Ⅱ的分子是C26H24O3 |
某二价的金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
| A、1:2 | B、1:4 |
| C、1:1 | D、1:3 |
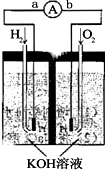 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.