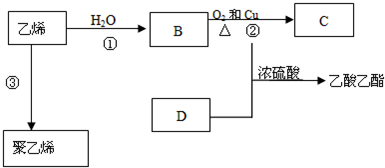
题目内容
8.NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 1.0L0.1 mol/•LNa2S溶液中含有的S2-离子数为0.1NA | |
| B. | 一定条件下,4.6g的Na完全与O2反应生成7.2g产物时失去的电子数为0.2NA | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 电镀铜时,若阴极得到电子数为2NA,则阳极质量减少不一定等于64g |
分析 A、S2-在溶液中会水解;
B、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
C、原子是化学变化中的最小微粒;
D、阳极上放电的不止是铜,还有比铜活泼的金属.
解答 解:A、S2-为弱酸根,在溶液中会水解,故溶液中的硫离子的个数小于0.1NA个,故A错误;
B、4.6g钠的物质的量为0.2mol,而钠反应后变为+1价,故0.2mol钠失去的电子数为0.2NA个,故B正确;
C、原子是化学变化中的最小微粒,故化学变化不能实现原子间的转化,故C错误;
D、阳极上放电的不止是铜,还有比铜活泼的金属,故若阴极得到电子数为2NA,则阳极质量减少不一定等于64g,会比64g小,故D正确.
故选BD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列物质:(1)Na(2)Br2 (3)Na2O (4)NO2(5)CO2(6)SO3(7)NH3(8)H2S(9)HCl (10)H2SO4 (11)Ba(OH)2(12)NaCl(13)蔗糖 (14)NaCl溶液,其中属于电解质的是( )
| A. | (1)(3)(6)(8)(9)(11) | B. | (2)(3)(6)(10)(11)(13) | C. | (3)(8)(9)(10)(11)(12) | D. | (4)(5)(7)(10)(11)(14) |
16.真菌聚酮(X)具有多种生物活性,一定条件下可分别转化为Y和Z.
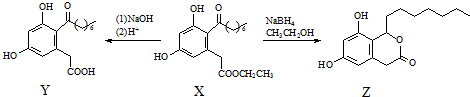
下列说法正确的是( )
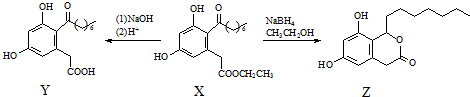
下列说法正确的是( )
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能发生氧化、还原、取代反应 | |
| C. | 一定条件下,1 mol X最多能与5 mol H2发生加成反应 | |
| D. | 1 mol Z最多可与含3 mol NaOH的溶液反应 |
3.向碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到钠盐Na2H3IO6.下列有关该反应的说法中错误的是( )
| A. | 在该反应中碘酸钠作还原剂 | |
| B. | 碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 | |
| C. | 反应中氧化产物与还原产物的物质的量之比为2:1 | |
| D. | 反应中生成1 mol Na2H3IO6转移2 mol电子 |
13.玻璃棒是化学实验中最常用的一种仪器.下列实验中要用到玻璃棒的是( )
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
20.等质量的钠进行下列实验,其中生成氢气最多的是( )
| A. | 将钠投入到足量水中 | |
| B. | 将钠用铝箔包好并刺一些小孔,再放入足量水中 | |
| C. | 将钠放入足量稀硫酸中 | |
| D. | 将钠放入足量碳酸氢钠溶液中 |
 .
.