题目内容
在海洋底部存在大量称为“可燃冰”的物质,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质.初步查明可燃冰是甲烷、乙烷等可燃性气体的水合物.有关可燃冰的下述推测中不正确的是( )
| A、高压、低温有助于可燃冰的形成 |
| B、构成可燃冰的原子间存在极性共价键 |
| C、可燃冰的微粒间可能存在一种比范德华力更强的相互作用力 |
| D、常温、常压下可燃冰是一种稳定的物质 |
考点:化石燃料与基本化工原料
专题:有机化合物的获得与应用
分析:A.高压、低温能使物质变为固态;
B.可燃冰的主要成分是甲烷;
C.可燃冰是甲烷分子居于水分子形成的笼中的产物;
D.在常温常压下,可燃冰易释放出甲烷、乙烷等可燃性气体.
B.可燃冰的主要成分是甲烷;
C.可燃冰是甲烷分子居于水分子形成的笼中的产物;
D.在常温常压下,可燃冰易释放出甲烷、乙烷等可燃性气体.
解答:
解:A.可燃冰形成、贮存于大海深处,海洋深处温度低,压强大,故高压、低温有助于可燃冰的形成,故A正确;
B.甲烷碳氢原子间存在极性共价键,故B正确;
C.可燃冰是甲烷分子居于水分子形成的笼中的产物,存在氢键,氢键比分子间作用力强,故C正确;
D.在常温常压下,可燃冰易释放出甲烷、乙烷等可燃性气体,不稳定,故D错误.
故选D.
B.甲烷碳氢原子间存在极性共价键,故B正确;
C.可燃冰是甲烷分子居于水分子形成的笼中的产物,存在氢键,氢键比分子间作用力强,故C正确;
D.在常温常压下,可燃冰易释放出甲烷、乙烷等可燃性气体,不稳定,故D错误.
故选D.
点评:本题考查可燃冰的组成与性质,注意习题中的信息分析物质的性质,读懂题意是解题的关键,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
某有机物的结构简式为: ,下列对其性质的叙述中不正确的是( )
,下列对其性质的叙述中不正确的是( )
 ,下列对其性质的叙述中不正确的是( )
,下列对其性质的叙述中不正确的是( )| A、不能与钠反应放出氢气 |
| B、能与溴水发生加成反应 |
| C、能发生加聚反应 |
| D、不能与新制的Cu(OH)2悬浊液反应 |
下列叙述正确的是( )
| A、常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
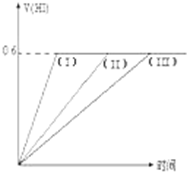 在一定温度下发生反应:I2(g)+H2(g)?2HI(g);并达平衡.HI的体积分数V(HI)%随时间变化如图曲线(II)所示.若改变反应条件,在甲条件下的变化如曲线(I)所示.在乙条件下的变化如曲线(III)所示.则甲条件、乙条件分别是( )
在一定温度下发生反应:I2(g)+H2(g)?2HI(g);并达平衡.HI的体积分数V(HI)%随时间变化如图曲线(II)所示.若改变反应条件,在甲条件下的变化如曲线(I)所示.在乙条件下的变化如曲线(III)所示.则甲条件、乙条件分别是( ) ①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当的催化剂.
| A、①⑤,③ | B、②⑤,④ |
| C、③⑤,② | D、③⑤,④ |
抗生素是能抑制某些微生物生长的一类物质,最早发现的一种天然抗生素是( )
| A、青霉素 | B、阿司匹林 |
| C、红霉素 | D、吗啡 |
常温下,甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、甲酸能与水以任意比互溶 |
| B、1mol/L甲酸溶液的pH值约为2 |
| C、10ml 1mol/L甲酸恰好与10ml?1mol/L NaOH溶液完全反应 |
| D、HCOONa溶液的pH值大于7 |
短周期元素X、Y、Z、W在周期表中的位置关系如图所示,则下列叙述中错误的是( )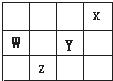

| A、四元素中,X的单质最稳定 |
| B、氢化物稳定性:HY>H2Z |
| C、原子半径:W>Y |
| D、W在周期表中的位置为:第2周期第5族 |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、0.1mol/LAlCl3溶液中含有的Cl-数目为0.3NA |
| B、室温下,42.0g己烯和丙烯的混合气体中含有的碳原子数为3NA |
| C、标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
| D、100mL18.4mol/L硫酸与足量铜反应,生成SO2的分子数为0.92NA |
由乙烯和乙酸蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
| A、10% | B、20% |
| C、30% | D、无法确定 |