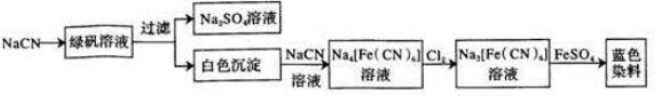
题目内容
10.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3固体.相应的实验过程可用如图表示: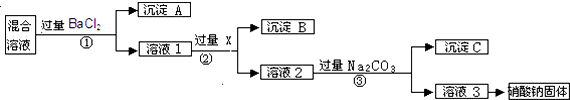
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X:AgNO3,沉淀A:BaSO4.
(2)上述实验流程中①②③步均要进行的实验操作是过滤(填操作名称)
(3)上述实验流程中加入过量的Na2CO3的目的是使溶液中的Ag+、Ba2+完全沉淀
(4)按此实验方案得到的溶液3中肯定含有Na2CO3(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的稀HNO3,之后若要获得固体NaNO3(溶解度受温度影响大)需进行的实验操作是冷却热饱和溶液(或蒸发浓缩冷却结晶)(填操作名称).
分析 由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为BaSO4,溶液1中含氯化钠、硝酸钠、氯化钡,②中加AgNO3后氯离子转化沉淀,沉淀B为AgCl,溶液2中含硝酸钠、硝酸银、硝酸钡,③中钡离子,银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钠和碳酸钠,转化中试剂过量保证离子完全转化为沉淀,以此来解答.
解答 解:由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为BaSO4,溶液1中含氯化钠、硝酸钠、氯化钡,②中加AgNO3后氯离子转化沉淀,沉淀B为AgCl,溶液2中含硝酸钠、硝酸银、硝酸钡,③中钡离子,银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钠和碳酸钠,
(1)由上述分析可知,X为AgNO3,沉淀A为BaSO4,故答案为:AgNO3;BaSO4;
(2)流程中①②③步均生成沉淀,需要进行过滤操作,故答案为:过滤;
(3)加入过量的Na2CO3的目的是使溶液中的Ag+、Ba2+完全沉淀,故答案为:使溶液中的Ag+、Ba2+完全沉淀;
(4)溶液3中肯定含有Na2CO3,可加适量的稀硝酸后蒸发结晶或加热冷却结晶得到纯净的硝酸钠,
故答案为:Na2CO3;稀HNO3;冷却热饱和溶液(或蒸发浓缩冷却结晶).
点评 本题考查物质分离、提纯实验方案的设计,为高考常见题型,侧重于学生的分析、实验能力的考查,把握流程中试剂的加入发生的化学反应及操作为解答的关键,注重实验的严密性和溶液的配制、物质提纯的考查,题目难度中等.

练习册系列答案
相关题目
20.下列描述涉及化学变化的是( )
| A. | 山崩地裂 | B. | 百炼成钢 | C. | 木已成舟 | D. | 花香四溢 |
1. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式 K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.已知:K300°C>K350°C,则该反应是放热 反应.(填“吸热”或者“放热”)
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变 e.容器内气体的颜色不再变化
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是增大反应物的浓度.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变 e.容器内气体的颜色不再变化
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是增大反应物的浓度.
18.下列离子方程式正确的是( )
| A. | 铜和稀硝酸的反应:Cu2++4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 氯气与水反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
5.某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则溶液中存在的离子可能是( )
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
19.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
则下列说法不正确的是( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |

 .
. 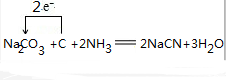 .
.