题目内容
某次实验需配制0.4mol?L-1NaOH溶液500mL.配制方法如下:
(1)配制该溶液应选用的玻璃仪器: ;
(2)用托盘天平准确称量 g固体NaOH;
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待 后,将烧杯中的溶液注入容量瓶中;
(4)用少量 洗涤烧杯以及玻璃棒2~3次,洗涤后的溶液 ,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面距离刻度线 时,改用 加蒸馏水至液面与刻度线相切.
(6)误差分析:(填偏高、偏低、无影响)若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将 ;操作(5)中,若定容时,眼睛俯视,则所配制的溶液浓度将 .
(1)配制该溶液应选用的玻璃仪器:
(2)用托盘天平准确称量
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待
(4)用少量
(5)向容量瓶中加入蒸馏水,到液面距离刻度线
(6)误差分析:(填偏高、偏低、无影响)若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV和m=nM来计算
(3)根据氢氧化钠固体溶于水中后放热来分析;
(4)根据洗涤的操作来分析;
(5)根据定容的操作来分析;
(6)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)根据n=cV和m=nM来计算
(3)根据氢氧化钠固体溶于水中后放热来分析;
(4)根据洗涤的操作来分析;
(5)根据定容的操作来分析;
(6)根据c=
| n |
| V |
解答:
解:(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需的玻璃仪器有烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(2)所需的氢氧化钠的物质的量n=cV=0.4mol/L×0.5L=0.2mol,质量m=nM=0.2mol×40g/mol=8.0g,故答案为:8.0;
(3)容量瓶不能受热,而氢氧化钠固体溶于水中后放热,故应待冷却至室温后,再移液,故答案为:冷却至室温;
(4)如果烧杯和玻璃棒不洗涤,会造成溶质的损失,导致所配溶液的浓度偏小,故用少量蒸馏水洗涤烧杯以及玻璃棒2~3次,洗涤后的溶液注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀,故答案为:蒸馏水,注入容量瓶;
(5)定容的操作是:向容量瓶中加入蒸馏水,到液面距离刻度线1-2cm时,改用胶头滴管加蒸馏水至液面与刻度线相切,故答案为:1-2cm,胶头滴管;
(6)若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;若定容时,眼睛俯视,则所配溶液的体积偏小,浓度偏高,故答案为:无影响,偏高.
(2)所需的氢氧化钠的物质的量n=cV=0.4mol/L×0.5L=0.2mol,质量m=nM=0.2mol×40g/mol=8.0g,故答案为:8.0;
(3)容量瓶不能受热,而氢氧化钠固体溶于水中后放热,故应待冷却至室温后,再移液,故答案为:冷却至室温;
(4)如果烧杯和玻璃棒不洗涤,会造成溶质的损失,导致所配溶液的浓度偏小,故用少量蒸馏水洗涤烧杯以及玻璃棒2~3次,洗涤后的溶液注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀,故答案为:蒸馏水,注入容量瓶;
(5)定容的操作是:向容量瓶中加入蒸馏水,到液面距离刻度线1-2cm时,改用胶头滴管加蒸馏水至液面与刻度线相切,故答案为:1-2cm,胶头滴管;
(6)若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;若定容时,眼睛俯视,则所配溶液的体积偏小,浓度偏高,故答案为:无影响,偏高.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
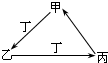 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为: 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: