题目内容
下列各组物质混合后一定没有氯气生成的是( )
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:实验室制备氯气,可用高锰酸钾、二氧化锰与浓盐酸反应,也可用NaClO或KClO3与NaCl在酸性条件下发生氧化还原反应生成氯气,以此解答该题.
解答:
解:A.酸性条件下,KMnO4可氧化氯离子生成氯气,故A不选;
B.酸性条件下,NaClO可氧化氯离子生成氯气,故B不选;
C.NaClO4氧化性较弱,且NaClO3应在酸性条件下氧化氯离子,不能生成氯气,故C选;
D.酸性条件下,KClO3、KCl发生氧化还原反应可生成氯气,故D不选.
故选C.
B.酸性条件下,NaClO可氧化氯离子生成氯气,故B不选;
C.NaClO4氧化性较弱,且NaClO3应在酸性条件下氧化氯离子,不能生成氯气,故C选;
D.酸性条件下,KClO3、KCl发生氧化还原反应可生成氯气,故D不选.
故选C.
点评:本题考查氯气的生成,为高频考点,侧重于学生的分析能力的考查,注意把握相关物质的性质,从氧化还原反应的角度解答该题,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
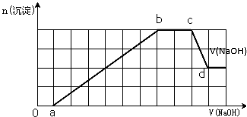

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |