题目内容
将铁铝矾[Al2Fe(SO4)4?xH2O]溶于水中,得到浅绿色溶液,下列有关该溶液的叙述正确的是( )
| A、铁铝矾有净水作用,其水溶液显中性 |
| B、向该溶液中加入Na2S溶液,有淡黄色沉淀 |
| C、在空气中,蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 |
| D、用惰性电极电解该溶液时,阴极区有沉淀 |
考点:镁、铝的重要化合物,二价Fe离子和三价Fe离子的检验
专题:
分析:将铁铝矾[Al2Fe(SO4)4?xH2O]溶于水中,得到浅绿色溶液,溶液含有亚铁离子和铝离子,可水解生成氢氧化铝,可用于净水,电解时,可生产氢氧化亚铁沉淀,以此解答该题.
解答:
解:A.铁铝矾为强酸弱碱盐,水解呈酸性,故A错误;
B.向该溶液中加入Na2S溶液,可生成FeS黑色沉淀,并水解生成氢氧化铝,故B错误;
C.硫酸是不挥发的酸,所以在空气中,蒸干并灼烧该溶液,最后所得的残留固体是硫酸铝和硫酸铁,故C错误;
D.电解时,阴极生成氢气和氢氧根离子,可生成氢氧化亚铁、氢氧化铝沉淀,如碱过量,则只生成氢氧化亚铁,故D正确.
故选D.
B.向该溶液中加入Na2S溶液,可生成FeS黑色沉淀,并水解生成氢氧化铝,故B错误;
C.硫酸是不挥发的酸,所以在空气中,蒸干并灼烧该溶液,最后所得的残留固体是硫酸铝和硫酸铁,故C错误;
D.电解时,阴极生成氢气和氢氧根离子,可生成氢氧化亚铁、氢氧化铝沉淀,如碱过量,则只生成氢氧化亚铁,故D正确.
故选D.
点评:本题考查了铝、铁的化合物的性质、盐的水解原理的应用等,为高频考点,侧重于学生的分析能力的考查,注意把握元素化合物知识、水解原理,题目难度不大.

练习册系列答案
相关题目
X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
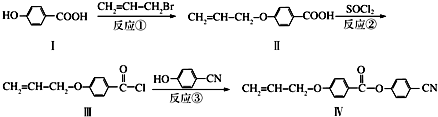
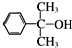 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是 为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:
为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案: